La mutarotation est l'évolution du pouvoir rotatoire accompagnant une équation chimique appelée épimérisation[1]. Dans la chimie des sucres, ce terme désigne l'épimérisation du carbone hémiacétal. Par exemple, dans le cas du glucose, la mise en solution d'α-D-glucose, en présence d'un catalyseur approprié (par exemple H+) conduit à un mélange de 35 % d'α-D-glucose et 65 % de β-D-glucose. Cette proportion à l'équilibre est dépendante du solvant (pyridine, acide éthanoïque).
La mutarotation a été décrite par le chimiste français Augustin-Pierre Dubrunfaut en 1846.
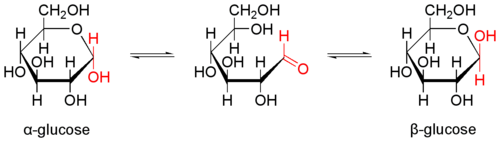
Bien que la forme cyclique soit la plus favorable, les oses sont en permanence en équilibre avec leur forme ouverte (forme centrale sur la figure ci-dessous), résultant de l'ouverture du cycle au niveau du carbone anomérique. Au moment de reformer la liaison hémiacétal qui referme le cycle, le groupe hydroxyle a la possibilité d'attaquer d'un côté ou de l'autre du carbone du groupement carbonyle. Le côté de l'attaque décidera si l'anomère formé est α ou β.
Références