|
–§—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–į
–§—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–į, —ā–į–ļ–∂–Ķ –§—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–į (–§–Ď–§-–į–∑–į, FBP —Ā–ĺ–ļ—Ä. –ĺ—ā –į–Ĺ–≥–Ľ. Fructose 1,6-bisphosphatase, —ą–ł—Ą—Ä –ö–§ 3.1.3.11) ‚ÄĒ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā –ł–∑ –≥—Ä—É–Ņ–Ņ—č —Ą–ĺ—Ā—Ą–į—ā–į–∑ (–ļ–Ľ–į—Ā—Ā –≥–ł–ī—Ä–ĺ–Ľ–į–∑—č), –ļ–į—ā–į–Ľ–ł–∑–ł—Ä—É—é—Č–ł–Ļ —Ä–Ķ–į–ļ—Ü–ł—é –≥–ł–ī—Ä–ĺ–Ľ–ł–∑–į —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į –ī–ĺ —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-6-—Ą–ĺ—Ā—Ą–į—ā–į —Ā –ĺ–Ī—Ä–į–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –Ĺ–Ķ–ĺ—Ä–≥–į–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —Ą–ĺ—Ā—Ą–į—ā–į –Ņ–ĺ —Ä–Ķ–į–ļ—Ü–ł–ł:
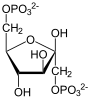 + H2O + H2O  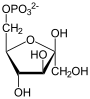 + Pi + Pi
–Ē–į–Ĺ–Ĺ–į—Ź —Ä–Ķ–į–ļ—Ü–ł—Ź –Ņ—Ä–ĺ—ā–Ķ–ļ–į–Ķ—ā –≤ –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑–Ķ –ł —Ü–ł–ļ–Ľ–Ķ –ö–į–Ľ—Ć–≤–ł–Ĺ–į, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ĺ—ā–Ĺ–ĺ—Ā—Ź—ā –ļ –į–Ĺ–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į–ľ–ł. –§—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–į –ļ–į—ā–į–Ľ–ł–∑–ł—Ä—É–Ķ—ā –ĺ–Ī—Ä–į—ā–Ĺ—É—é —Ä–Ķ–į–ļ—Ü–ł—é, –Ņ–ĺ –ĺ—ā–Ĺ–ĺ—ą–Ķ–Ĺ–ł—é –ļ —Ä–Ķ–į–ļ—Ü–ł–ł, –ļ–į—ā–į–Ľ–ł–∑–ł—Ä—É–Ķ–ľ–ĺ–Ļ —Ą–ĺ—Ā—Ą–ĺ—Ą—Ä—É–ļ—ā–ĺ–ļ–ł–Ĺ–į–∑–ĺ–Ļ –≤ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–Ķ –≥–Ľ–ł–ļ–ĺ–Ľ–ł–∑–į[1][2]. –≠—ā–ł —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā—č –ļ–į—ā–į–Ľ–ł–∑–ł—Ä—É—é—ā —Ä–Ķ–į–ļ—Ü–ł–ł —ā–ĺ–Ľ—Ć–ļ–ĺ –≤ –ĺ–ī–Ĺ–ĺ–ľ –Ĺ–į–Ņ—Ä–į–≤–Ľ–Ķ–Ĺ–ł–ł, –ł —Ä–Ķ–≥—É–Ľ–ł—Ä—É—é—ā—Ā—Ź –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—ā–į–ľ–ł, —ā–į–ļ–ł–ľ–ł –ļ–į–ļ —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-2,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā, —ā–į–ļ —á—ā–ĺ –≤—č—Ā–ĺ–ļ–į—Ź –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć –ĺ–ī–Ĺ–ĺ–≥–ĺ –ł–∑ –ī–≤—É—Ö —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–ĺ–≤ —Ā–ĺ–Ņ—Ä–ĺ–≤–ĺ–∂–ī–į–Ķ—ā—Ā—Ź –Ĺ–ł–∑–ļ–ĺ–Ļ –į–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć—é –ī—Ä—É–≥–ĺ–≥–ĺ. –ė–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-2,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā —Ā–Ņ–ĺ—Ā–ĺ–Ī–Ķ–Ĺ —ā–į–ļ–∂–Ķ –į–Ľ–Ľ–ĺ—Ā—ā–Ķ—Ä–ł—á–Ķ—Ā–ļ–ł —Ā–≤—Ź–∑—č–≤–į—ā—Ć—Ā—Ź —Ā —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–ĺ–Ļ, —ā–Ķ–ľ —Ā–į–ľ—č–ľ –ł–Ĺ–≥–ł–Ī–ł—Ä—É—Ź –Ķ—Ď, –Ĺ–ĺ –į–ļ—ā–ł–≤–ł—Ä—É–Ķ—ā –Ņ—Ä–ł —ć—ā–ĺ–ľ —Ą–ĺ—Ā—Ą–ĺ—Ą—Ä—É–ļ—ā–ĺ–ļ–ł–Ĺ–į–∑—É. –§–Ď–§-–į–∑–į —É—á–į—Ā—ā–≤—É–Ķ—ā –≤ —Ä–į–∑–Ľ–ł—á–Ĺ—č—Ö –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł—Ö –Ņ—É—ā—Ź—Ö –ł –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź —É –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–ĺ–≤. –§–Ď–§-–į–∑–Ķ –ī–Ľ—Ź –ļ–į—ā–į–Ľ–ł–∑–į –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –ļ–ĺ—Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ —ā—Ä–Ķ–Ī—É—é—ā—Ā—Ź –ł–ĺ–Ĺ—č –ī–≤—É—Ö–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ—č—Ö –ľ–Ķ—ā–į–Ľ–Ľ–ĺ–≤ (–Ņ—Ä–Ķ–ī–Ņ–ĺ—á—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–Ķ–Ķ –úg2+ –ł –ún2+), –Ņ—Ä–ł —ć—ā–ĺ–ľ –ł–ĺ–Ĺ—č –Ľ–ł—ā–ł—Ź Li+ —Ź–≤–Ľ—Ź—é—ā—Ā—Ź –ľ–ĺ—Č–Ĺ—č–ľ–ł –ł–Ĺ–≥–ł–Ī–ł—ā–ĺ—Ä–į–ľ–ł.
–ď–Ķ–Ĺ, –ļ–ĺ–ī–ł—Ä—É—é—Č–ł–Ļ –ī–į–Ĺ–Ĺ—č–Ķ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā ‚ÄĒ FBP1, –Ľ–ĺ–ļ–į–Ľ–ł–∑–ĺ–≤–į–Ĺ –Ĺ–į 9-–Ļ —Ö—Ä–ĺ–ľ–ĺ—Ā–ĺ–ľ–Ķ.
–°—ā—Ä—É–ļ—ā—É—Ä–į
–Ď—č–Ľ–ĺ –ĺ—ā–ľ–Ķ—á–Ķ–Ĺ–ĺ, —á—ā–ĺ —Ą–ĺ–Ľ–ī —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑—č —Ā–≤–ł–Ĺ—Ć–ł –ł–ī–Ķ–Ĺ—ā–ł—á–Ķ–Ĺ –ł–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ-1-—Ą–ĺ—Ā—Ą–į—ā–į–∑–Ķ (–ė–ú–§-–į–∑–Ķ)[3].
–ė–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ–Ņ–ĺ–Ľ–ł—Ą–ĺ—Ā—Ą–į—ā 1-—Ą–ĺ—Ā—Ą–į—ā–į–∑–į (–ė–ü–§-–į–∑–į), –ė–ú–§-–į–∑–į –ł –§–Ď–§-–į–∑–į –ł–ľ–Ķ—é—ā –ľ–ĺ—ā–ł–≤ –Ņ–ĺ—Ā–Ľ–Ķ–ī–ĺ–≤–į—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser), –ļ–ĺ—ā–ĺ—Ä—č–Ļ, –ļ–į–ļ –Ī—č–Ľ–ĺ –Ņ–ĺ–ļ–į–∑–į–Ĺ–ĺ, —Ā–≤—Ź–∑—č–≤–į–Ķ—ā –ł–ĺ–Ĺ—č –ľ–Ķ—ā–į–Ľ–Ľ–ĺ–≤ –ł —É—á–į—Ā—ā–≤—É–Ķ—ā –≤ –ļ–į—ā–į–Ľ–ł–∑–Ķ. –≠—ā–ĺ—ā –ľ–ĺ—ā–ł–≤ —ā–į–ļ–∂–Ķ –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –≤ –ī–ł—Ā—ā–į–Ĺ—Ü–ł–ĺ–Ĺ–Ĺ–ĺ —Ā–≤—Ź–∑–į–Ĺ–Ĺ—č—Ö –≥—Ä–ł–Ī–ļ–ĺ–≤—č—Ö, –Ī–į–ļ—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ—č—Ö –ł –ī—Ä–ĺ–∂–∂–Ķ–≤—č—Ö –≥–ĺ–ľ–ĺ–Ľ–ĺ–≥–į—Ö –ė–ú–§-–į–∑—č. –Ď—č–Ľ–ĺ –≤—č—Ā–ļ–į–∑–į–Ĺ–ĺ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–ĺ–∂–Ķ–Ĺ–ł–Ķ, —á—ā–ĺ —ć—ā–ł –Ī–Ķ–Ľ–ļ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź—é—ā –ī—Ä–Ķ–≤–Ĺ–Ķ–Ķ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ĺ–ĺ-–ļ–ĺ–Ĺ—Ā–Ķ—Ä–≤–į—ā–ł–≤–Ĺ–ĺ–Ķ —Ā–Ķ–ľ–Ķ–Ļ—Ā—ā–≤–ĺ, –≤–ĺ–≤–Ľ–Ķ—á—Ď–Ĺ–Ĺ–ĺ–Ķ –≤ —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—É—ā–ł, –≤–ļ–Ľ—é—á–į—Ź —Ā–ł–≥–Ĺ–į–Ľ–ł–∑–į—Ü–ł—é –ł–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ–ĺ–ľ, –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑, —É—Ā–≤–ĺ–Ķ–Ĺ–ł–Ķ —Ā—É–Ľ—Ć—Ą–į—ā–į –ł, –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ, –ľ–Ķ—ā–į–Ī–ĺ–Ľ–ł–∑–ľ —Ö–ł–Ĺ–ĺ–Ĺ–į[4].
–†–į—Ā–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ –≤–ł–ī–ĺ–≤
–Ę—Ä–ł —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ –≥—Ä—É–Ņ–Ņ—č —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑—č –Ī—č–Ľ–ł –ł–ī–Ķ–Ĺ—ā–ł—Ą–ł—Ü–ł—Ä–ĺ–≤–į–Ĺ—č —É —ć—É–ļ–į—Ä–ł–ĺ—ā –ł –Ī–į–ļ—ā–Ķ—Ä–ł–Ļ (–§–Ď–§-–į–∑—č I‚ÄĒIII)[5]. –Ě–ł –ĺ–ī–Ĺ–į –ł–∑ —ć—ā–ł—Ö –≥—Ä—É–Ņ–Ņ –ī–ĺ —Ā–ł—Ö –Ņ–ĺ—Ä –Ĺ–Ķ –Ī—č–Ľ–į –Ĺ–į–Ļ–ī–Ķ–Ĺ–į –≤ –į—Ä—Ö–Ķ—Ź—Ö, –ĺ–ī–Ĺ–į–ļ–ĺ, –Ĺ–ĺ–≤–į—Ź –≥—Ä—É–Ņ–Ņ–į –§–Ď–§-–į–∑ (–§–Ď–§-–į–∑—č IV), –ļ–ĺ—ā–ĺ—Ä–į—Ź —ā–į–ļ–∂–Ķ –Ņ—Ä–ĺ—Ź–≤–Ľ—Ź–Ķ—ā —Ā–≤–ĺ–Ļ—Ā—ā–≤–į –ł–Ĺ–ĺ–∑–ł—ā–ĺ–Ľ –ľ–ĺ–Ĺ–ĺ—Ą–ĺ—Ā—Ą–į—ā–į–∑—č, –Ĺ–Ķ–ī–į–≤–Ĺ–ĺ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–į —É –į—Ä—Ö–Ķ–Ļ[6].
–Ě–ĺ–≤–į—Ź –≥—Ä—É–Ņ–Ņ–į –§–Ď–§-–į–∑ (–§–Ď–§-–į–∑—č V) –≤—Ā—ā—Ä–Ķ—á–į–Ķ—ā—Ā—Ź –≤ —ā–Ķ—Ä–ľ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č—Ö –į—Ä—Ö–Ķ—Ź—Ö –ł –≥–ł–Ņ–Ķ—Ä—ā–Ķ—Ä–ľ–ĺ—Ą–ł–Ľ—Ć–Ĺ—č—Ö –Ī–į–ļ—ā–Ķ—Ä–ł—Ź—Ö Aquifex aeolicus[7].
–£—á–į—Ā—ā–ł–Ķ –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –ī–ł–į–Ī–Ķ—ā–į
–§—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑–į —ā–į–ļ–∂–Ķ –ł–≥—Ä–į–Ķ—ā –ļ–Ľ—é—á–Ķ–≤—É—é —Ä–ĺ–Ľ—Ć –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł —Ā–į—Ö–į—Ä–Ĺ–ĺ–≥–ĺ –ī–ł–į–Ī–Ķ—ā–į 2 —ā–ł–Ņ–į. –≠—ā–ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā—Ā—Ź –≥–ł–Ņ–Ķ—Ä–≥–Ľ–ł–ļ–Ķ–ľ–ł–Ķ–Ļ (–Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł–Ķ–Ļ –≥–Ľ—é–ļ–ĺ–∑—č –≤ –ļ—Ä–ĺ–≤–ł), –ļ–ĺ—ā–ĺ—Ä–į—Ź –≤—č–∑—č–≤–į–Ķ—ā –ľ–Ĺ–ĺ–∂–Ķ—Ā—ā–≤–ĺ —Ā–Ķ—Ä—Ć—Ď–∑–Ĺ—č—Ö –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ, –ł –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł —á–į—Ā—ā–ĺ –Ņ—Ä–ł—Ö–ĺ–ī–ł—ā—Ā—Ź –į–ļ—Ü–Ķ–Ĺ—ā–ł—Ä–ĺ–≤–į—ā—Ć –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ –Ĺ–į —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —É—Ä–ĺ–≤–Ĺ—Ź —Ā–į—Ö–į—Ä–į –≤ –ļ—Ä–ĺ–≤–ł[8][9][10]. –£—Ā–ł–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑ –≤ –Ņ–Ķ—á–Ķ–Ĺ–ł —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ĺ–Ļ –ł–∑ –ĺ—Ā–Ĺ–ĺ–≤–Ĺ—č—Ö –Ņ—Ä–ł—á–ł–Ĺ –Ņ–Ķ—Ä–Ķ–Ņ—Ä–ĺ–ī—É–ļ—Ü–ł–ł –≥–Ľ—é–ļ–ĺ–∑—č —É —ć—ā–ł—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –ł –Ņ–ĺ—ć—ā–ĺ–ľ—É –ł–Ĺ–≥–ł–Ī–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ä–į–∑—É–ľ–Ĺ—č–ľ —Ā–Ņ–ĺ—Ā–ĺ–Ī–ĺ–ľ –ī–Ľ—Ź –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź —Ā–į—Ö–į—Ä–Ĺ–ĺ–≥–ĺ –ī–ł–į–Ī–Ķ—ā–į 2 —ā–ł–Ņ–į.
–Ē–Ķ—Ą–ł—Ü–ł—ā
–ú—É—ā–į—Ü–ł–ł –≤ –≥–Ķ–Ĺ–Ķ FBP1 –ľ–ĺ–≥—É—ā –Ņ—Ä–ł–≤–ĺ–ī–ł—ā—Ć –ļ –Ĺ–į—Ā–Ľ–Ķ–ī—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł —Ą—Ä—É–ļ—ā–ĺ–∑–ĺ-1,6-–Ī–ł—Ā—Ą–ĺ—Ā—Ą–į—ā–į–∑—č. –≠—ā–ĺ –į—É—ā–ĺ—Ā–ĺ–ľ–Ĺ–ĺ-—Ä–Ķ—Ü–Ķ—Ā—Ā–ł–≤–Ĺ–ĺ–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–Ķ, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É—é—Č–Ķ–Ķ—Ā—Ź –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź–ľ –Ņ—Ä–ĺ—Ü–Ķ—Ā—Ā–į –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑–į, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ—Ä–ł–≤–ĺ–ī—Ź—ā –ļ –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł–ł, –Ľ–į–ļ—ā–į—ā–į—Ü–ł–ī–ĺ–∑—É, –≥–ł–Ņ–Ķ—Ä–≤–Ķ–Ĺ—ā–ł–Ľ—Ź—Ü–ł–ł, —Ā—É–ī–ĺ—Ä–ĺ–≥–į–ľ –ł –≥–ł–Ņ–ĺ–≥–Ľ–ł–ļ–Ķ–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ļ–ĺ–ľ–Ķ. –ě—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ –ĺ–Ņ–į—Ā–Ĺ—č —ć—ā–ł –Ņ—Ä–ĺ—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź —Ā—Ä–Ķ–ī–ł –Ĺ–ĺ–≤–ĺ—Ä–ĺ–∂–ī—Ď–Ĺ–Ĺ—č—Ö, —ā–į–ļ –ļ–į–ļ —Ā—Ä–Ķ–ī–ł –Ĺ–ł—Ö –Ĺ–į–Ī–Ľ—é–ī–į–Ķ—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–į—Ź –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć.
–ü—Ä–ł–ľ–Ķ—á–į–Ĺ–ł—Ź
- ‚ÜĎ Marcus F., Harrsch P.B. Amino acid sequence of spinach chloroplast fructose-1,6-bisphosphatase (–į–Ĺ–≥–Ľ.) // Archives of Biochemistry and Biophysics[–į–Ĺ–≥–Ľ.] : journal. ‚ÄĒ Elsevier, 1990. ‚ÄĒ May (vol. 279, no. 1). ‚ÄĒ P. 151‚ÄĒ157. ‚ÄĒ doi:10.1016/0003-9861(90)90475-E. ‚ÄĒ PMID 2159755.
- ‚ÜĎ Marcus F., Gontero B., Harrsch P.B., Rittenhouse J. Amino acid sequence homology among fructose-1,6-bisphosphatases (–į–Ĺ–≥–Ľ.) // Biochemical and Biophysical Research Communications : journal. ‚ÄĒ 1986. ‚ÄĒ March (vol. 135, no. 2). ‚ÄĒ P. 374‚ÄĒ381. ‚ÄĒ doi:10.1016/0006-291X(86)90005-7. ‚ÄĒ PMID 3008716.
- ‚ÜĎ Zhang Y., Liang J.Y., Lipscomb W.N. Structural similarities between fructose-1,6-bisphosphatase and inositol monophosphatase (–į–Ĺ–≥–Ľ.) // Biochemical and Biophysical Research Communications : journal. ‚ÄĒ 1993. ‚ÄĒ February (vol. 190, no. 3). ‚ÄĒ P. 1080‚ÄĒ1083. ‚ÄĒ doi:10.1006/bbrc.1993.1159. ‚ÄĒ PMID 8382485.
- ‚ÜĎ York J.D., Ponder J.W., Majerus P.W. Definition of a metal-dependent/Li(+)-inhibited phosphomonoesterase protein family based upon a conserved three-dimensional core structure (–į–Ĺ–≥–Ľ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. ‚ÄĒ 1995. ‚ÄĒ May (vol. 92, no. 11). ‚ÄĒ P. 5149‚ÄĒ5153. ‚ÄĒ doi:10.1073/pnas.92.11.5149. ‚ÄĒ PMID 7761465. ‚ÄĒ PMC 41866.
- ‚ÜĎ Donahue J.L., Bownas J.L., Niehaus W.G., Larson T.J. Purification and characterization of glpX-encoded fructose 1, 6-bisphosphatase, a new enzyme of the glycerol 3-phosphate regulon of Escherichia coli (–į–Ĺ–≥–Ľ.) // Journal of Bacteriology[–į–Ĺ–≥–Ľ.] : journal. ‚ÄĒ 2000. ‚ÄĒ October (vol. 182, no. 19). ‚ÄĒ P. 5624‚ÄĒ5627. ‚ÄĒ doi:10.1128/jb.182.19.5624-5627.2000. ‚ÄĒ PMID 10986273. ‚ÄĒ PMC 111013.
- ‚ÜĎ Stec B., Yang H., Johnson K.A., Chen L., Roberts M.F. MJ0109 is an enzyme that is both an inositol monophosphatase and the 'missing' archaeal fructose-1,6-bisphosphatase (–į–Ĺ–≥–Ľ.) // Nature Structural Biology : journal. ‚ÄĒ 2000. ‚ÄĒ November (vol. 7, no. 11). ‚ÄĒ P. 1046‚ÄĒ1050. ‚ÄĒ doi:10.1038/80968. ‚ÄĒ PMID 11062561.
- ‚ÜĎ Rashid N., Imanaka H., Kanai T., Fukui T., Atomi H., Imanaka T. A novel candidate for the true fructose-1,6-bisphosphatase in archaea (–į–Ĺ–≥–Ľ.) // The Journal of Biological Chemistry : journal. ‚ÄĒ 2002. ‚ÄĒ August (vol. 277, no. 34). ‚ÄĒ P. 30649‚ÄĒ30655. ‚ÄĒ doi:10.1074/jbc.M202868200. ‚ÄĒ PMID 12065581.
- ‚ÜĎ Dang* Qun, Van Poelje Paul D., Erion Mark D. Chapter 11. The Discovery and Development of MB07803, a Second-Generation Fructose-1,6-bisphosphatase Inhibitor with Improved Pharmacokinetic Properties, as a Potential Treatment of Type 2 Diabetes (–į–Ĺ–≥–Ľ.) // Drug Discovery. ‚ÄĒ 2012. ‚ÄĒ P. 306‚ÄĒ323. ‚ÄĒ ISBN 9781849734141. ‚ÄĒ ISSN 2041-3211. ‚ÄĒ doi:10.1039/9781849735322-00306. [–ł—Ā–Ņ—Ä–į–≤–ł—ā—Ć]
- ‚ÜĎ Hofmann, F.B. and Munchen. ¬ęHandbook of experimental pharmacology: Diabetes ‚ÄĒ perspectives in drug therapy.¬Ľ Springer-Verlag Berlin Heidelverg 203 (2011). Web.
- ‚ÜĎ van Poelje P. D., Potter S. C., Chandramouli V. C., Landau B. R., Dang Q., Erion M. D. Inhibition of fructose 1,6-bisphosphatase reduces excessive endogenous glucose production and attenuates hyperglycemia in Zucker diabetic fatty rats. (–į–Ĺ–≥–Ľ.) // Diabetes. ‚ÄĒ 2006. ‚ÄĒ June (vol. 55, no. 6). ‚ÄĒ P. 1747‚ÄĒ1754. ‚ÄĒ doi:10.2337/db05-1443. ‚ÄĒ PMID 16731838. [–ł—Ā–Ņ—Ä–į–≤–ł—ā—Ć]
 –°—Ā—č–Ľ–ļ–ł –Ĺ–į –≤–Ĺ–Ķ—ą–Ĺ–ł–Ķ —Ä–Ķ—Ā—É—Ä—Ā—č |
|---|
–°–Ľ–ĺ–≤–į—Ä–ł –ł —ć–Ĺ—Ü–ł–ļ–Ľ–ĺ–Ņ–Ķ–ī–ł–ł | |
|---|
 |
|---|
| –ź–ļ—ā–ł–≤–Ĺ–ĺ—Ā—ā—Ć | |
|---|
| –†–Ķ–≥—É–Ľ—Ź—Ü–ł—Ź | |
|---|
| –ö–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł—Ź | |
|---|
| –Ę–ł–Ņ—č | |
|---|
 |
|---|
| –ď–Ľ–ł–ļ–ĺ–Ľ–ł–∑ | |
|---|
| –Ę–ĺ–Ľ—Ć–ļ–ĺ –≥–Ľ—é–ļ–ĺ–Ĺ–Ķ–ĺ–≥–Ķ–Ĺ–Ķ–∑ | |
|---|
| –†–Ķ–≥—É–Ľ—Ź—Ü–ł—Ź | |
|---|
|
|