Cloreto de acetila
Alerta sobre risco à saúde
|
![]()
|
|
|
| Nome IUPAC
|
Ethanoyl chloride
|
| Outros nomes
|
Acetyl chloride
|
| Identificadores
|
| Número CAS
|
75-36-5
|
| Número RTECS
|
AO6390000
|
| SMILES
|
|
| Propriedades
|
| Fórmula molecular
|
CH3COCl
|
| Massa molar
|
78.5 g/mol[1]
|
| Aparência
|
líquido incolor
|
| Densidade
|
1.11 g/ml, líquido[1]
|
| Ponto de fusão
|
−112 °C[1]
|
| Ponto de ebulição
|
51 °C[1]
|
| Solubilidade em água
|
Reage[1]
|
| Viscosidade
|
320 hPa (20 °C)[1]
|
| Estrutura
|
| Momento dipolar
|
2.45 D
|
| Riscos associados
|
| Classificação UE
|
Flammable (F)
Corrosive (C)
|
| Frases R
|
R11, R14, R34
|
| Frases S
|
S1/2, S9, S16, S26, S45
|
| Ponto de fulgor
|
5 °C
|
Temperatura
de auto-ignição
|
390 °C
|
| Limites de explosividade
|
7.3–19%
|
| Compostos relacionados
|
| Outros aniões/ânions
|
Iodeto de acetila
|
| cloretos de acila relacionados
|
Cloreto de metanoila
Cloreto de propanoila
Cloreto de butirila
|
| Compostos relacionados
|
Ácido acético
|
| Página de dados suplementares
|
| Estrutura e propriedades
|
n, εr, etc.
|
| Dados termodinâmicos
|
Phase behaviour
Solid, liquid, gas
|
| Dados espectrais
|
UV, IV, RMN, EM
|
Exceto onde denotado, os dados referem-se a
materiais sob condições normais de temperatura e pressão
Referências e avisos gerais sobre esta caixa.
Alerta sobre risco à saúde.
|
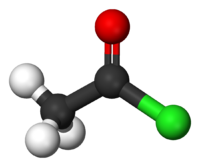
Cloreto de acetila, também conhecido como cloreto de etanoíla, é um cloreto ácido (também conhecido como cloreto de acila) derivado do ácido acético (ácido etanóico). Tem fórmula CH3COCl e pertence a classe de composto orgânicos chamados haletos de acila. A fórmula estrutural do cloreto de acetila é mostrada a direita. À temperatura e pressão ambiente, é um líquido claro e incolor. O cloreto de acetila não existe na natureza, porque em contato com água se hidrolisa em ácido acético e cloreto de hidrogênio. De fato, se manuseado ao ar livre ele produz fumaça branca própria da hidrólise com a umidade do ar. A fumaça é momentaneamente cloreto de hidrogênio gasoso o qual forma gotículas no ar com o vapor d'água.
Síntese
É quimicamente sintetizado pela reação de ácido acético com cloreto de tionila.
- CH3COO-H + O=SCl2 → CH3COCl + SO2 + H-Cl
Também pode ser sintetizado através da reação de ácido acético com tricloreto de fósforo:
- CH3COO-H + PCl3 → CH3COCl + H-Cl
Reações
O cloreto de acetila é usado como reagente para acetilação na síntese ou derivação de compostos químicos. Exemplos de reações de acetilação incluem processos de acilação tal como os de esterificação (ver abaixo) e a reação de Friedel-Crafts.
- CH3COCl + HO-CH2-CH3 → CH3-COO-CH2-CH3 + H-Cl
Frequentemente tais acilações são realizadas na presença de uma base tal qual a piridina, trietilamina, ou DMAP, as quais como catalisadores ajudam a promover a reação e como base neutralizam o HCl resultante.
Acetilação é a introdução de um grupo acetila via acilação usando um reagente tal qual o cloreto de acetila ou anidrido acético. Um grupo acetila é um grupo acila tendo a fórmula
- -C(=O)-CH3.
Para informação adicional sobre os tipos de reações químicas nas quais compostos tais como o cloreto de acetila podem participar, veja haleto de acila.
Referências
Ligações externas