–î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α (―²–Α–Κ–Ψ–Ε –≥–Β–Ϋ–Ϋ–Α –≤–Α–Κ―Ü–Η–Ϋ–Α , –≤–Α–Κ―Ü–Η–Ϋ–Α –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –Ϋ―É–Κ–Μ–Β―½–Ϋ–Ψ–≤–Η―Ö –Κ–Η―¹–Μ–Ψ―² ) βÄî –≥–Β–Ϋ–Ϋ–Ψ-―•–Ϋ–Ε–Β–Ϋ–Β―Ä–Ϋ–Α –Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―è, ―è–Κ–Α –Ω―•―¹–Μ―è –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –≤ –Κ–Μ―•―²–Η–Ϋ―É –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―î –Ω―Ä–Ψ–¥―É–Κ―É–≤–Α–Ϋ–Ϋ―è –±―•–Μ–Κ―•–≤ –Ω–Α―²–Ψ–≥–Β–Ϋ―•–≤ –Α–±–Ψ –Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η―Ö –Α–Ϋ―²–Η–≥–Β–Ϋ―•–≤ ―²–Α –≤–Η–Κ–Μ–Η–Κ–Α―î ―•–Φ―É–Ϋ–Ϋ―É ―Ä–Β–Α–Κ―Ü―•―é . –£–≤–Β–¥–Β–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ –Ϋ–Α–Ζ–Η–≤–Α―é―²―¨ –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Ψ―é ―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―î―é. –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―è –Φ–Α―î –Ϋ–Η–Ζ–Κ―É –Ω–Β―Ä–Β–≤–Α–≥ ―É –Ω–Ψ―Ä―•–≤–Ϋ―è–Ϋ–Ϋ―• –Ζ―• –Ζ–≤–Η―΅–Α–Ι–Ϋ–Η–Φ–Η –≤–Α–Κ―Ü–Η–Ϋ–Α–Φ–Η . –½–Ψ–Κ―Ä–Β–Φ–Α –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ, ―â–Ψ ―²–Α–Κ―• –≤–Α–Κ―Ü–Η–Ϋ–Η –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―é―²―¨ –Ϋ–Β –Μ–Η―à–Β –≤–Η―Ä–Ψ–±–Μ–Β–Ϋ–Ϋ―è –Α–Ϋ―²–Η―²―•–Μ (–≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Η–Ι ―•–Φ―É–Ϋ―•―²–Β―²), –Α –Ι ―¹–Ω–Β―Ü–Η―³―•―΅–Ϋ―É ―Ü–Η―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨ (–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι ―•–Φ―É–Ϋ―•―²–Β―²), ―â–Ψ ―Ä–Α–Ϋ―•―à–Β –±―É–Μ–Ψ –¥–Ψ―¹―è–Ε–Ϋ–Η–Φ –Μ–Η―à–Β –Ζ –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é –Ε–Η–≤–Η―Ö –≤–Α–Κ―Ü–Η–Ϋ . –Γ―¨–Ψ–≥–Ψ–¥–Ϋ―• –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –Ϋ–Β –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É―é―²―¨ –¥–Μ―è –Μ―•–Κ―É–≤–Α–Ϋ–Ϋ―è –Μ―é–¥–Η–Ϋ–Η, –Ω―Ä–Ψ―²–Β –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ―É―î―²―¨―¹―è, ―â–Ψ –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Α ―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―è –¥–Ψ–Ω–Ψ–Φ–Ψ–Ε–Β –Ω–Ψ–¥–Ψ–Μ–Α―²–Η ―Ü―•–Μ–Η–Ι ―Ä―è–¥ –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ―¨.
–Ü–¥–Β―è –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É–≤–Α―²–Η ―³―Ä–Α–≥–Φ–Β–Ϋ―²–Η –î–ù–ö –¥–Μ―è –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ –Ζ'―è–≤–Η–Μ–Α―¹―è ―É 50-60-―²―• ―Ä–Ψ–Κ–Η. –ü―•―¹–Μ―è ―¹–Β―Ä―•―½ –¥–Ψ―¹–Μ―•–¥―•–≤ –±―É–Μ–Ψ –Ζ'―è―¹–Ψ–≤–Α–Ϋ–Ψ, ―â–Ψ –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Α ―•–Ϋ―³–Ψ―Ä–Φ–Α―Ü―•―è –î–ù–ö –Ζ–±–Β―Ä―•–≥–Α―î –Ζ–¥–Α―²–Ϋ―•―¹―²―¨ ―²―Ä–Α–Ϋ―¹–Κ―Ä–Η–±―É–≤–Α―²–Η―¹―¨ ―• ―²―Ä–Α–Ϋ―¹–Μ―é–≤–Α―²–Η―¹―¨ –Ω―•―¹–Μ―è –Ω–Β―Ä–Β–Ϋ–Β―¹–Β–Ϋ–Ϋ―è –≤ ―•–Ϋ―à―É –Κ–Μ―•―²–Η–Ϋ―É[ 1] [ 2] –Ω–Ψ–Μ―•–Ψ–Φ―•―î–Μ―•―²―É ―¹―²–Η–Φ―É–Μ―é―î –≤–Η―Ä–Ψ–±–Μ–Β–Ϋ–Ϋ―è –Α–Ϋ―²–Η―²―•–Μ[ 3] [ 4] [ 5] [ 6] [ 7] –£–Ü–¦ [ 8] ―Ä–Α–Κ–Ψ–≤–Η―Ö –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ―¨ [ 9] [ 10] –£–Ü–¦ , –≤―•―Ä―É―¹―É –≥―Ä–Η–Ω―É, –≥–Β―Ä–Ω–Β―¹―É, –≥–Β–Ω–Α―²–Η―²―É B, –Ζ–±―É–¥–Ϋ–Η–Κ–Α –Φ–Α–Μ―è―Ä―•―½. –†–Β–Ζ―É–Μ―¨―²–Α―²–Η –≤―¹―•―Ö ―²–Β―¹―²―•–≤ –≤–Η―è–≤–Η–Μ–Η―¹―è ―Ü―•–Μ–Κ–Ψ–Φ –Ψ–±–Ϋ–Α–¥―•–Ι–Μ–Η–≤–Η–Φ–Η: –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η ―¹―²–Α–±―•–Μ―¨–Ϋ–Ψ –Β–Κ―¹–Ω―Ä–Β―¹―É–≤–Α–Μ–Η―¹―¨, –Ω―Ä–Ψ–≤–Ψ–Κ―É–≤–Α–Μ–Η ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨ ―²–Α –Ϋ–Β –≤–Η–Κ–Μ–Η–Κ–Α–Μ–Η ―¹–Β―Ä–Ι–Ψ–Ζ–Ϋ–Η―Ö –Ω–Ψ–±―•―΅–Ϋ–Η―Ö –Β―³–Β–Κ―²―•–≤ , ―â–Ψ ―¹―²–Α–Μ–Ψ –Ω–Ψ―à―²–Ψ–≤―Ö–Ψ–Φ –¥–Μ―è ―½―Ö –Ω–Ψ–¥–Α–Μ―¨―à–Ψ–≥–Ψ –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ–Ϋ―è[ 11]
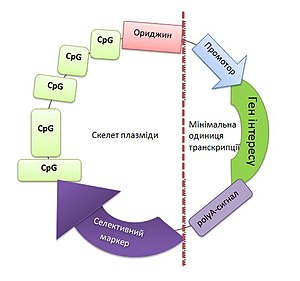
–Γ―²―Ä―É–Κ―²―É―Ä–Α –î–ù–ö –≤–Α–Κ―Ü–Η–Ϋ–Η, ―¹―²–≤–Ψ―Ä–Β–Ϋ–Ψ―½ –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –Ω–Μ–Α–Ζ–Φ―•–¥–Ϋ–Ψ–≥–Ψ –≤–Β–Κ―²–Ψ―Ä–Α . –û―Ä–Η–¥–Ε–Η–Ϋ (–Ζ –Α–Ϋ–≥–Μ. origin) βÄî ―²–Ψ―΅–Κ–Α –Ω–Ψ―΅–Α―²–Κ―É ―Ä–Β–Ω–Μ―•–Κ–Α―Ü―•―½.–½–Α ―¹―²―Ä―É–Κ―²―É―Ä–Ψ―é –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α βÄî ―Ü–Β –≤–±―É–¥–Ψ–≤–Α–Ϋ–Α ―É –≤–Β–Κ―²–Ψ―Ä –Ϋ―É–Κ–Μ–Β–Ψ―²–Η–¥–Ϋ–Α –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―¨ , ―â–Ψ –Κ–Ψ–¥―É―î –Ω–Β–≤–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ ―΅–Η –Α–Ϋ―²–Η–≥–Β–Ϋ–Η. –£–Β–Κ―²–Ψ―Ä–Ψ–Φ –≤ –≥–Β–Ϋ–Ϋ―•–Ι ―•–Ϋ–Ε–Β–Ϋ–Β―Ä―•―½ –Ϋ–Α–Ζ–Η–≤–Α―é―²―¨ –Φ–Ψ–Μ–Β–Κ―É–Μ―É –Ϋ―É–Κ–Μ–Β―½–Ϋ–Ψ–≤–Ψ―½ –Κ–Η―¹–Μ–Ψ―²–Η , ―è–Κ–Α ―¹–Μ―É–≥―É―î –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Ψ–≥–Ψ –Φ–Α―²–Β―Ä―•–Α–Μ―É –¥–Ψ –Κ–Μ―•―²–Η–Ϋ–Η ―²–Α –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―î –Ι–Ψ–≥–Ψ ―Ä–Β–Ω–Μ―•–Κ–Α―Ü―•―é ―΅–Η –Β–Κ―¹–Ω―Ä–Β―¹―•―é. –†–Α–Ϋ―•―à–Β –¥–Μ―è ―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―²―É–≤–Α–Ϋ–Ϋ―è –≥–Β–Ϋ―•–≤ –≤ –Κ–Μ―•―²–Η–Ϋ―É –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É–≤–Α–Μ–Η –≤–Β–Κ―²–Ψ―Ä–Η –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –≤―•―Ä―É―¹―•–≤: –Φ–Ψ–¥–Η―³―•–Κ–Ψ–≤–Α–Ϋ–Ψ–≥–Ψ (–Ψ―¹–Μ–Α–±–Μ–Β–Ϋ–Ψ–≥–Ψ) –≤―•―Ä―É―¹―É –Ϋ–Α―²―É―Ä–Α–Μ―¨–Ϋ–Ψ―½ –≤―•―¹–Ω–Η, –Α–¥–Β–Ϋ–Ψ–≤―•―Ä―É―¹―•–≤ ―²–Α ―Ä–Β―²―Ä–Ψ–≤―•―Ä―É―¹―•–≤ . –£―•―Ä―É―¹–Ϋ―• –≤–Β–Κ―²–Ψ―Ä–Η ―î –¥–Ψ―¹―²–Α―²–Ϋ―¨–Ψ –Β―³–Β–Κ―²–Η–≤–Ϋ–Η–Φ–Η, –Ω―Ä–Ψ―²–Β –Φ–Α―é―²―¨ –Ζ–Ϋ–Α―΅–Ϋ―É –Ι–Φ–Ψ–≤―•―Ä–Ϋ―•―¹―²―¨ ―Ä–Ψ–Ζ–≤–Η―²–Κ―É –Ω–Ψ–±―•―΅–Ϋ–Η―Ö –Β―³–Β–Κ―²―•–≤ , –Ω–Ψ–≤'―è–Ζ–Α–Ϋ―É –Ζ –≤―•–¥–Ϋ–Ψ―¹–Ϋ–Ψ –≤–Η―¹–Ψ–Κ–Ψ―é ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ―•―¹―²―é ―¹–Α–Φ–Ψ–≥–Ψ –≤–Β–Κ―²–Ψ―Ä–Α. –Δ–Ψ–Φ―É –Ϋ–Α ―¹―¨–Ψ–≥–Ψ–¥–Ϋ―• ―è–Κ –≤–Β–Κ―²–Ψ―Ä ―΅–Α―¹―²―•―à–Β –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―É –Ω–Μ–Α–Ζ–Φ―•–¥―É βÄî –Ϋ–Β–≤–Β–Μ–Η–Κ―É ―¹―²–Α–±―•–Μ―¨–Ϋ―É –Κ―•–Μ―¨―Ü–Β–≤―É –Φ–Ψ–Μ–Β–Κ―É–Μ―É –î–ù–ö, –Ζ–¥–Α―²–Ϋ―É –¥–Ψ –Α–≤―²–Ψ–Ϋ–Ψ–Φ–Ϋ–Ψ―½ ―Ä–Β–Ω–Μ―•–Κ–Α―Ü―•―½ . –Γ–Α–Φ–Α –Ω–Ψ ―¹–Ψ–±―• –Ω–Μ–Α–Ζ–Φ―•–¥–Α –Ϋ–Β –≤–Η–Κ–Μ–Η–Κ–Α―î –Ω–Ψ―²―Ä―•–±–Ϋ–Ψ―½ ―¹–Ω–Β―Ü–Η―³―•―΅–Ϋ–Ψ―½ ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•, –¥–Μ―è ―Ü―¨–Ψ–≥–Ψ –≤ –Ϋ–Β―½ –≤―à–Η–≤–Α―é―²―¨ –≥–Β–Ϋ–Η ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ–Η―Ö –±―•–Μ–Κ―•–≤. –Δ–Α–Κ–Ψ–Ε –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α –Ω–Ψ–≤–Η–Ϋ–Ϋ–Α –Φ―•―¹―²–Η―²–Η ―Ä–Β–≥―É–Μ―è―²–Ψ―Ä–Ϋ―• –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ–Ψ―¹―²―• , –Ϋ–Β–Ψ–±―Ö―•–¥–Ϋ―• –¥–Μ―è –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –≥–Β–Ϋ―•–≤ –≤ –Κ–Μ―•―²–Η–Ϋ–Α―Ö –Β―É–Κ–Α―Ä―•–Ψ―² . –™–Ψ―²–Ψ–≤―É –î–ù–ö-–Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―é –¥–Ψ―¹―²–Α–≤–Μ―è―é―²―¨ –≤ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―É –Κ–Μ―•―²–Η–Ϋ―É , –¥–Β –Ϋ–Α―Ä–Ψ―â―É―î―²―¨―¹―è –Κ―•–Μ―¨–Κ―•―¹―²―¨ ―½―½ –Κ–Ψ–Ω―•–Ι. –ü―•―¹–Μ―è ―Ü―¨–Ψ–≥–Ψ –Ω―Ä–Ψ–≤–Ψ–¥―è―²―¨ –≤–Η–¥―•–Μ–Β–Ϋ–Ϋ―è –Ι –Ψ―΅–Η―â–Β–Ϋ–Ϋ―è –Ω–Μ–Α–Ζ–Φ―•–¥, ―è–Κ―• –Ϋ–Β―¹―É―²―¨ –Ω–Ψ―²―Ä―•–±–Ϋ―É –≤―¹―²–Α–≤–Κ―É[ 12]
–£–Α–Ε–Μ–Η–≤–Η–Φ –Β―²–Α–Ω–Ψ–Φ ―¹―²–≤–Ψ―Ä–Β–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ ―î –¥–Η–Ζ–Α–Ι–Ϋ (–Κ–Ψ–Ϋ―¹―²―Ä―É―é–≤–Α–Ϋ–Ϋ―è) –≤–Β–Κ―²–Ψ―Ä–Α. –û–±–Ψ–≤'―è–Ζ–Κ–Ψ–≤–Η–Φ–Η ―¹―²―Ä―É–Κ―²―É―Ä–Α–Φ–Η –Ω–Μ–Α–Ζ–Φ―•–¥–Ϋ–Ψ–≥–Ψ –≤–Β–Κ―²–Ψ―Ä–Α ―î ―¹–Α–Ι―²–Η ―Ä–Β―¹―²―Ä–Η–Κ―Ü―•―½, ―¹–Β–Μ–Β–Κ―²–Η–≤–Ϋ–Η–Ι –Φ–Α―Ä–Κ–Β―Ä ―²–Α ―²–Ψ―΅–Κ–Α –Ω–Ψ―΅–Α―²–Κ―É ―Ä–Β–Ω–Μ―•–Κ–Α―Ü―•―½ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –≤ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―•–Ι –Κ–Μ―•―²–Η–Ϋ―•. –©–Ψ–±–Η –Ζ–¥―•–Ι―¹–Ϋ―é–≤–Α–≤―¹―è ―¹–Η–Ϋ―²–Β–Ζ –Α–Ϋ―²–Η–≥–Β–Ϋ―É, –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α –Ω–Ψ–≤–Η–Ϋ–Ϋ–Α –Φ―•―¹―²–Η―²–Η –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä ―• ―¹–Η–≥–Ϋ–Α–Μ –Ω–Ψ–Μ―•–Α–¥–Β–Ϋ―•–Μ―é–≤–Α–Ϋ–Ϋ―è . –ü―Ä–Ψ–Φ–Ψ―²–Ψ―Ä ―î –≤–Α–Ε–Μ–Η–≤–Η–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–Φ –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―• –≤–Α–Κ―Ü–Η–Ϋ–Η , –Ψ―¹–Κ―•–Μ―¨–Κ–Η –≤–Η–Ζ–Ϋ–Α―΅–Α―î ―¹–Η–Μ―É ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•: ―΅–Η–Φ –±―•–Μ―¨―à–Α –Β–Κ―¹–Ω―Ä–Β―¹―•―è –≥–Β–Ϋ―É, ―â–Ψ –Κ–Ψ–¥―É―î –≤―•―Ä―É―¹–Ϋ–Η–Ι ―΅–Η –Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ, ―²–Η–Φ ―¹–Η–Μ―¨–Ϋ―•―à–Α ―•–Φ―É–Ϋ–Ϋ–Α –≤―•–¥–Ω–Ψ–≤―•–¥―¨. –ù–Α–Ι―΅–Α―¹―²―•―à–Β –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä –≤―•―Ä―É―¹―É SV40 –Α–±–Ψ ―Ü–Η―²–Ψ–Φ–Β–≥–Α–Μ–Ψ–≤―•―Ä―É―¹―É (CMV). –î–Μ―è ―¹―²–Α–±―•–Μ―•–Ζ–Α―Ü―•―½ –Φ–†–ù–ö-―²―Ä–Α–Ϋ―¹–Κ―Ä–Η–Ω―²―•–≤ –≤ –Ω–Μ–Α–Ζ–Φ―•–¥―É –≤–±―É–¥–Ψ–≤―É―é―²―¨ ―¹–Η–≥–Ϋ–Α–Μ –Ω–Ψ–Μ―•–Α–¥–Β–Ϋ―•–Μ―é–≤–Α–Ϋ–Ϋ―è , ―΅–Α―¹―²―•―à–Β –Ζ–Α –≤―¹–Β, –Ψ―²―Ä–Η–Φ–Α–Ϋ–Η–Ι –Ζ –≥–Β–Ϋ―É –≥–Ψ―Ä–Φ–Ψ–Ϋ―É ―Ä–Ψ―¹―²―É –±–Η–Κ–Α (BGH ) –Α–±–Ψ –≤―•―Ä―É―¹―É SV40. –·–Κ ―¹–Β–Μ–Β–Κ―²–Η–≤–Ϋ―• –Φ–Α―Ä–Κ–Β―Ä–Η –≤–Η–±–Η―Ä–Α―é―²―¨ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―• –≥–Β–Ϋ–Η ―¹―²―•–Ι–Κ–Ψ―¹―²―• –¥–Ψ –Α–Ϋ―²–Η–±―•–Ψ―²–Η–Κ―•–≤ , ―΅–Α―¹―²–Ψ ―Ü–Β –≥–Β–Ϋ ―¹―²―•–Ι–Κ–Ψ―¹―²―• –¥–Ψ –Κ–Α–Ϋ–Α–Φ―•―Ü–Η–Ϋ―É. –ü―Ä–Η –Κ–Ψ–Ϋ―¹―²―Ä―É―é–≤–Α–Ϋ–Ϋ―• –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –Ϋ–Α–Ι–±―•–Μ―¨―à –Ω–Ψ–Ω―É–Μ―è―Ä–Ϋ–Ψ―é ―î ―²–Ψ―΅–Κ–Α –Ω–Ψ―΅–Α―²–Κ―É ―Ä–Β–Ω–Μ―•–Κ–Α―Ü―•―½ Escherichia coli [ 13]
–£–Β–Κ―²–Ψ―Ä ―î –≤–Α–Ε–Μ–Η–≤–Η–Φ –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–Φ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η, –Ω―Ä–Ψ―²–Β ―½―½ ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ―•―¹―²―¨ –≤–Η–Ζ–Ϋ–Α―΅–Α―î―²―¨―¹―è ―¹–Α–Φ–Β –≤―¹―²–Α–≤–Κ–Ψ―é βÄî –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―é –î–ù–ö, ―â–Ψ –Κ–Ψ–¥―É―î –Α–Ϋ―²–Η–≥–Β–Ϋ. –Γ–Β―Ä–Β–¥ –≤―•―Ä―É―¹–Ϋ–Η―Ö –Α–Ϋ―²–Η–≥–Β–Ϋ―•–≤ –¥–Μ―è ―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½ –Ϋ–Α–Ι–Κ―Ä–Α―â–Β –Ω―•–¥―Ö–Ψ–¥―è―²―¨ –±―•–Μ–Κ–Η –Ζ–Μ–Η―²―²―è βÄî ―Ü–Β –≤―•–¥–Ϋ–Ψ―¹–Ϋ–Ψ –Κ–Ψ–Ϋ―¹–Β―Ä–≤–Α―²–Η–≤–Ϋ―• –±―•–Μ–Κ–Η, ―è–Κ―• –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―é―²―¨ –Ω―Ä–Ψ–Ϋ–Η–Κ–Ϋ–Β–Ϋ–Ϋ―è –≤―•―Ä―É―¹―É –≤ –Κ–Μ―•―²–Η–Ϋ―É. –î–Μ―è –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ –Ω―Ä–Ψ―²–Η –≥―Ä–Α–Φ-–Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Η―Ö –±–Α–Κ―²–Β―Ä―•–Ι –≤ –Ω–Μ–Α–Ζ–Φ―•–¥–Ϋ–Η–Ι –≤–Β–Κ―²–Ψ―Ä –¥–Ψ―Ü―•–Μ―¨–Ϋ–Ψ –≤–±―É–¥–Ψ–≤―É–≤–Α―²–Η –≥–Β–Ϋ–Η ―²–Η―Ö –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ–Η―Ö –±―•–Μ–Κ―•–≤, ―è–Κ―• –≤–Η–Ζ–Ϋ–Α―΅–Α―é―²―¨ –Ω–Α―²–Ψ–≥–Β–Ϋ–Β–Ζ –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ϋ―è. –½-–Ω–Ψ–Φ―•–Ε –±―•–Μ–Κ―•–≤ –≥―Ä–Α–Φ-–Ϋ–Β–≥–Α―²–Η–≤–Ϋ–Η―Ö –±–Α–Κ―²–Β―Ä―•–Ι –≤–Η―¹–Ψ–Κ―É ―•–Φ―É–Ϋ–Ϋ–Ψ–≥–Β–Ϋ―•―¹―²―¨ –Φ–Α―é―²―¨ –Ω–Ψ―Ä–Η–Ϋ–Η[ 14] ―²–Β―Ä–Α–Ω–Β–≤―²–Η―΅–Ϋ–Η―Ö –Ω―Ä–Ψ―²–Η–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η―Ö –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ –±―•–Μ–Κ–Η-–Φ–Α―Ä–Κ–Β―Ä–Η ―Ä–Α–Κ–Ψ–≤–Η―Ö –Κ–Μ―•―²–Η–Ϋ[ 15]
–™–Ψ―²–Ψ–≤―É –≤–Α–Κ―Ü–Η–Ϋ―É –Ω–Ψ―²―Ä―•–±–Ϋ–Ψ –¥–Ψ―¹―²–Α–≤–Η―²–Η –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ –Μ―é–¥–Η–Ϋ–Η ―΅–Η ―²–≤–Α―Ä–Η–Ϋ–Η, –¥–Β ―½―½ ―²–Ψ―΅–Κ–Α –Ω―Ä–Η–Ζ–Ϋ–Α―΅–Β–Ϋ–Ϋ―è βÄî –Α–Ϋ―²–Η–≥–Β–Ϋ-–Ω―Ä–Β–Ζ–Β–Ϋ―²―É―é―΅―• –Κ–Μ―•―²–Η–Ϋ–Η (–ê–ü–ö) βÄî –Φ–Α–Κ―Ä–Ψ―³–Α–≥–Η , –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η , –£-–Μ―•–Φ―³–Ψ―Ü–Η―²–Η . –Δ―É―² –±―É–¥–Β –≤―•–¥–±―É–≤–Α―²–Η―¹―¨ ―¹–Η–Ϋ―²–Β–Ζ ―• –Ω–Ψ―¹―²―²―Ä–Α–Ϋ―¹–Μ―è―Ü―•–Ι–Ϋ–Α –Φ–Ψ–¥–Η―³―•–Κ–Α―Ü―•―è –Α–Ϋ―²–Η–≥–Β–Ϋ–Ϋ―É, –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ –≤―•–Ϋ –±―É–¥–Β –≤–±―É–¥–Ψ–≤–Α–Ϋ–Η–Ι –≤ –Φ–Β–Φ–±―Ä–Α–Ϋ―É –Κ–Μ―•―²–Η–Ϋ–Η, ―â–Ψ–± –Ω―Ä–Η–≤–Β―Ä–Ϋ―É―²–Η ―É–≤–Α–≥―É ―•–Φ―É–Ϋ–Ϋ–Ψ―½ ―¹–Η―¹―²–Β–Φ–Η. –û―¹–Ϋ–Ψ–≤–Α –Ω―Ä–Ψ–±–Μ–Β–Φ–Α –Ω–Ψ–Μ―è–≥–Α―î –≤ –¥–Ψ―¹―²–Α–≤―Ü―• –¥–Ψ―¹―²–Α―²–Ϋ―¨–Ψ―½ –Κ―•–Μ―¨–Κ–Ψ―¹―²―• –Ω–Μ–Α–Ζ–Φ―•–¥–Η –≤ –ê–ü–ö. –€–Β―²–Ψ–¥–Η –¥–Ψ―¹―²–Α–≤–Κ–Η –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Ψ–≥–Ψ –Φ–Α―²–Β―Ä―•–Α–Μ―É –≤ –Κ–Μ―•―²–Η–Ϋ–Ϋ―É –Ω–Ψ–¥―•–Μ―è―é―²―¨ –Ζ–Α–Ζ–≤–Η―΅–Α–Ι –Ϋ–Α 2 –≥―Ä―É–Ω–Η: –≤―•―Ä―É―¹–Ϋ―• ―• –Ϋ–Β–≤―•―Ä―É―¹–Ϋ―•. –û―¹–Κ―•–Μ―¨–Κ–Η –≤―•―Ä―É―¹–Ϋ―• –≤–Β–Κ―²–Ψ―Ä–Η –Φ–Α―é―²―¨ ―Ä―è–¥ ―¹―É―²―²―î–≤–Η―Ö –Ϋ–Β–¥–Ψ–Μ―•–Κ―•–≤, –≤ –¥–Α–Ϋ–Ψ–Φ―É ―Ä–Ψ–Ζ–¥―•–Μ―• –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―• –Μ–Η―à–Β –Ϋ–Β–≤―•―Ä―É―¹–Ϋ―• –Φ–Β―²–Ψ–¥–Η –¥–Ψ―¹―²–Α–≤–Κ–Η –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ.
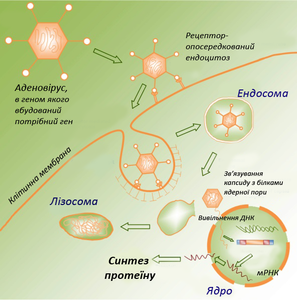
–ù–Α –Ω–Ψ―΅–Α―²–Κ―É 1990-―Ö –¥–Μ―è –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –î–ù–ö –≤ –Κ–Μ―•―²–Η–Ϋ―É –Ϋ–Α–Ι–±―•–Μ―¨―à –Ω–Ψ―à–Η―Ä–Β–Ϋ–Η–Φ –±―É–Μ–Η –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤―• –Φ―•–Κ―Ä–Ψ―•–Ϋ'―î–Κ―Ü―•―½ , ―â–Ψ –Ζ―É–Φ–Ψ–≤–Μ–Β–Ϋ–Ψ –Ω―Ä–Ψ―¹―²–Ψ―²–Ψ―é –Φ–Β―²–Ψ–¥―É. –î–Μ―è ―Ü―¨–Ψ–≥–Ψ –î–ù–ö ―Ä–Ψ–Ζ―΅–Η–Ϋ―è―é―²―¨ ―É –≤–Ψ–¥―• –Α–±–Ψ ―•–Ζ–Ψ―²–Ψ–Ϋ―•―΅–Ϋ–Ψ–Φ―É ―Ä–Ψ–Ζ―΅–Η–Ϋ―• , –Ω―Ä–Η –Ω–Ψ―²―Ä–Β–±―• –¥–Ψ–¥–Α―é―²―¨ –Α–¥'―é–≤–Α–Ϋ―² (―Ä–Β―΅–Ψ–≤–Η–Ϋ―É, ―â–Ψ –Ω―•–¥―¹–Η–Μ―é―î ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨). –î–Α–Μ―• –Ζ–Α –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é ―²–Ψ–Ϋ–Κ–Ψ―½ ―¹–Κ–Μ―è–Ϋ–Ψ―½ ―²―Ä―É–±–Κ–Η ―Ä–Ψ–Ζ―΅–Η–Ϋ –≤–≤–Ψ–¥―è―²―¨ –≤ –Φ'―è–Ζ–Ψ–≤―É ―²–Κ–Α–Ϋ–Η–Ϋ―É , –¥–Β ―Ä–Ψ–Μ―¨ –ê–ü–ö –≤–Η–Κ–Ψ–Ϋ―É―é―²―¨ –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η. –ü–Ψ―²―Ä–Α–Ω–Η–≤―à–Η –≤ ―è–¥―Ä–Ψ –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ–Ψ―½ –Κ–Μ―•―²–Η–Ϋ–Η –≤–Α–Κ―Ü–Η–Ϋ–Α –Ω–Ψ―΅–Η–Ϋ–Α―î –Β–Κ―¹–Ω―Ä–Β―¹―É–≤–Α―²–Η―¹―¨ ―• –≤―•–¥–±―É–≤–Α―î―²―¨―¹―è ―¹–Η–Ϋ―²–Β–Ζ –±―•–Μ–Κ―•–≤-–Α–Ϋ―²–Η–≥–Β–Ϋ―•–≤. –½–Α –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é –Φ―•–Κ―Ä–Ψ―•–Ϋ'―î–Κ―Ü―•–Ι –î–ù–ö ―²–Α–Κ–Ψ–Ε –Φ–Ψ–Ε–Ϋ–Α –≤–≤–Ψ–¥–Η―²–Η –Ω―•–¥―à–Κ―•―Ä–Ϋ–Ψ, –≤ ―²–Η–Φ―É―¹ , –Ω–Β―΅―•–Ϋ–Κ―É , –Ω―É―Ö–Μ–Η–Ϋ–Ϋ―É ―²–Κ–Α–Ϋ–Η–Ϋ―É[ 16] [ 17] –Κ–Μ―•―²–Η–Ϋ –¦–Α–Ϋ–≥–Β―Ä–≥–Α–Ϋ―¹–Α (–Ω―•–¥―²–Η–Ω –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ–Η―Ö –Κ–Μ―•―²–Η–Ϋ), –Ω―Ä–Η–≤–Α–±–Μ–Η–≤–Ψ―é –Φ―•―à–Β–Ϋ–Ϋ―é –¥–Μ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ ―î ―à–Κ―•―Ä–Α[ 18] –Φ―•–Κ―Ä–Ψ–Ϋ . –Ü―¹–Ϋ―É―é―²―¨ ―Ä―•–Ζ–Ϋ―• –≤–Α―Ä―•–Α–Ϋ―²–Η ―•–Ϋ―²―Ä–Α–¥–Β―Ä–Φ–Α–Μ―¨–Ϋ–Ψ―½ –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½. –ü―Ä–Ψ―¹―²―•―à–Η–Ι –≤–Κ–Μ―é―΅–Α―î ―Ä–Ψ–Ζ–Ω―É―à–Β–Ϋ–Ϋ―è –Φ–Α―¹–Η–≤–Ψ–Φ –Φ―•–Κ―Ä–Ψ–≥–Ψ–Μ–Ψ–Κ ―Ä–Ψ–≥–Ψ–≤–Ψ–≥–Ψ ―à–Α―Ä―É ―à–Κ―•―Ä–Η (–Ζ–Ψ–≤–Ϋ―•―à–Ϋ―•–Ι ―à–Α―Ä ―à–Κ―•―Ä–Η, –Ζ–Α–Ζ–≤–Η―΅–Α–Ι 10-20 –Φ–Κ–Φ), ―â–Ψ–±–Η –Ζ–±―•–Μ―¨―à–Η―²–Η ―½―½ –Ω―Ä–Ψ–Ϋ–Η–Κ–Ϋ―•―¹―²―¨ –¥–Μ―è –Ω–Ψ–¥–Α–Μ―¨―à–Ψ–≥–Ψ –Φ―•―¹―Ü–Β–≤–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Ϋ―è ―Ä–Ψ–Ζ―΅–Η–Ϋ―É –î–ù–ö. –ï―³–Β–Κ―²–Η–≤–Ϋ―•―à–Η–Φ ―î –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –Φ―•–Κ―Ä–Ψ–≥–Ψ–Μ–Ψ–Κ, –Ω–Ψ–Κ―Ä–Η―²–Η―Ö ―¹―É―Ö–Ψ―é –≤–Α–Κ―Ü–Η–Ϋ–Ψ―é, ―è–Κ–Α ―Ä–Ψ–Ζ―΅–Η–Ϋ―è―î―²―¨―¹―è –≤–Ε–Β –Ω―•–¥ ―à–Κ―•―Ä–Ψ―é[ 19]
–ü―Ä–Η–Ϋ―Ü–Η–Ω –¥―•―½ –Β–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―½ . –ï–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Η–Ι ―¹―²―Ä―É–Φ –Ω–Β―Ä–Β–≥―Ä―É–Ω–Ψ–≤―É―î –Μ―•–Ω―•–¥–Η –Ω–Μ–Α–Ζ–Φ–Α–Μ–Β–Φ–Η ―²–Α–Κ–Η–Φ ―΅–Η–Ϋ–Ψ–Φ, ―â–Ψ ―É―²–≤–Ψ―Ä―é―î―²―¨―¹―è –≥―•–¥―Ä–Ψ―³―•–Μ―¨–Ϋ–Η–Ι (–Ζ–≤–Β―Ä―Ö―É) –Α–±–Ψ –≥―•–¥―Ä–Ψ―³–Ψ–±–Ϋ–Η–Ι (–Ζ–Ϋ–Η–Ζ―É) –Κ–Α–Ϋ–Α–Μ. –ü―Ä–Ψ―Ö–Ψ–¥–Ε–Β–Ϋ–Ϋ―è –≥―•–¥―Ä–Ψ―³―•–Μ―¨–Ϋ–Ψ―½ –Φ–Ψ–Μ–Β–Κ―É–Μ–Η –î–ù–ö –Φ–Ψ–Ε–Μ–Η–≤–Β –Μ–Η―à–Β ―΅–Β―Ä–Β–Ζ –≤–Β―Ä―Ö–Ϋ―•–Ι –≤–Α―Ä―•–Α–Ϋ―² –Ω–Ψ―Ä–Η.–ï–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―è βÄî ―²―Ä–Α–¥–Η―Ü―•–Ι–Ϋ–Η–Ι –Ω―•–¥―Ö―•–¥ –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η –î–ù–ö –≤ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η ―• –Κ―É–Μ―¨―²―É―Ä–Η –Κ–Μ―•―²–Η–Ϋ , ―è–Κ–Η–Ι –±–Α–Ζ―É―î―²―¨―¹―è –Ϋ–Α –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―• –Β–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Ψ–≥–Ψ ―•–Φ–Ω―É–Μ―¨―¹―É. –Δ–Α–Κ–Η–Ι ―•–Φ–Ω―É–Μ―¨―¹ ―¹―²–≤–Ψ―Ä―é―î –Ω–Ψ―Ä–Η –≤ –Κ–Μ―•―²–Η–Ϋ–Ϋ―•–Ι –Φ–Β–Φ–±―Ä–Α–Ϋ―• , ―â–Ψ ―¹–Ω―Ä–Η―è―î –≤―Ö–Ψ–¥–Ε–Β–Ϋ–Ϋ―é –Ϋ–Β–≥–Α―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Ψ―½ –î–ù–ö. –Π–Β–Ι ―¹–Ω–Ψ―¹―•–± –±―É–≤ –Ζ–Α–Ω–Ψ–Ζ–Η―΅–Β–Ϋ–Η–Ι –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ ―²–≤–Α―Ä–Η–Ϋ ―²–Α –Μ―é–¥–Η–Ϋ–Η ―• –¥–Ψ–Ζ–≤–Ψ–Μ―è―î –Ζ–Ϋ–Α―΅–Ϋ–Ψ –Ω―•–¥–≤–Η―â–Η―²–Η –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –Ζ–≤–Η―΅–Α–Ι–Ϋ–Ψ―½ ―•–Ϋ'―î–Κ―Ü―•―½. –ü―Ä–Η–Μ–Α–¥ –¥–Μ―è –Β–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―½ –Φ―•―¹―²–Η―²―¨ –¥–Ε–Β―Ä–Β–Μ–Ψ –Β–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Ψ–≥–Ψ ―¹―²―Ä―É–Φ―É ―²–Α –Ψ–¥–Ϋ–Ψ―Ä–Α–Ζ–Ψ–≤―É ―¹―•―²–Κ―É, ―è–Κ–Α ―¹–Κ–Μ–Α–¥–Α―î―²―¨―¹―è –Ζ ―à–Ω―Ä–Η―Ü–Α ―²–Α –≥–Ψ–Μ–Ψ–Κ-–Β–Μ–Β–Κ―²―Ä–Ψ–¥―•–≤ . –®–Ω―Ä–Η―Ü –≤–≤–Ψ–¥–Η―²―¨ –≤–Α–Κ―Ü–Η–Ϋ―É –≤ –Φ'―è–Ζ–Ψ–≤―É ―²–Κ–Α–Ϋ–Η–Ϋ―É, –Α –Β–Μ–Β–Κ―²―Ä–Ψ–¥–Η ―¹―²–≤–Ψ―Ä―é―é―²―¨ –Β–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Β –Ω–Ψ–Μ–Β , ―è–Κ–Β –Ω–Ψ–Μ–Β–≥―à―É―î –≤―Ö–Ψ–¥–Ε–Β–Ϋ–Ϋ―è –î–ù–ö –≤ –Φ―•–Ψ―Ü–Η―²–Η ―• –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η . –ù–Α ―¹―¨–Ψ–≥–Ψ–¥–Ϋ―• ―Ä–Ψ–Ζ―Ä–Ψ–±–Μ–Β–Ϋ―• –Ω―Ä–Η―¹―²―Ä–Ψ―½, ―è–Κ―• –¥–Ψ–Ζ–≤–Ψ–Μ―è―é―²―¨ –Ω―•–¥–≤–Η―â–Η―²–Η –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ ―É 1000 ―Ä–Α–Ζ―•–≤ ―É –Ω–Ψ―Ä―•–≤–Ϋ―è–Ϋ–Ϋ―• –Ζ―• –Ζ–≤–Η―΅–Α–Ι–Ϋ–Ψ―é ―•–Ϋ'―î–Κ―Ü―•―î―é. –ï–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―é –Φ–Ψ–Ε–Ϋ–Α –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É–≤–Α―²–Η ―è–Κ –¥–Μ―è –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤–Ψ–≥–Ψ, ―²–Α–Κ ―• –¥–Μ―è –Ω―•–¥―à–Κ―•―Ä–Ϋ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η. –ù–Β–¥–Ψ–Μ―•–Κ–Α–Φ–Η ―î –Ϋ–Β–Ζ–Ϋ–Α―΅–Ϋ–Α –±–Ψ–Μ―é―΅―•―¹―²―¨ –≤ –Φ―•―¹―Ü―• ―•–Ϋ'―î–Κ―Ü―•―½, –Ω–Ψ―²―Ä–Β–±–Α –≤ ―¹–Ω–Β―Ü―•–Α–Μ―•–Ζ–Ψ–≤–Α–Ϋ–Η―Ö –Ω―Ä–Η―¹―²―Ä–Ψ―è―Ö[ 18] –Β–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Ψ–≥–Ψ –Ω–Ψ–Μ―è –Φ–Ψ–Ε–Ϋ–Α –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É–≤–Α―²–Η –Φ–Α–≥–Ϋ―•―²–Ϋ–Β . –Δ–Α–Κ―• –Ω―Ä–Η―¹―²―Ä–Ψ―½ –¥―•―é―²―¨ –Ω–Ψ ―²–Ψ–Φ―É –Ε –Ω―Ä–Η–Ϋ―Ü–Η–Ω―É, –Ω―Ä–Ψ―²–Β ―É ―Ü―¨–Ψ–Φ―É ―Ä–Α–Ζ―• –Ω―Ä–Ψ―Ü–Β–¥―É―Ä–Α ―î –Ω–Ψ–≤–Ϋ―•―¹―²―é –±–Β–Ζ–±–Ψ–Μ―•―¹–Ϋ–Ψ―é ―• –Φ–Β–Ϋ―à –Ω–Ψ―à–Κ–Ψ–¥–Ε―É―î –Κ–Μ―•―²–Η–Ϋ–Η[ 20]
–î―•―è –Β–Μ–Β–Κ―²―Ä–Η―΅–Ϋ–Ψ–≥–Ψ –Ω–Ψ–Μ―è –Ϋ–Β –Μ–Η―à–Β –Ω–Ψ―¹–Η–Μ―é―î –Ω–Ψ–≥–Μ–Η–Ϋ–Α–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –Κ–Μ―•―²–Η–Ϋ–Α–Φ–Η, –Α –Ι ―¹―²–Η–Φ―É–Μ―é―î –≤–Η―Ä–Ψ–±–Μ–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•. –½–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –Β–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―½ –Ω―Ä–Η–Ζ–≤–Ψ–¥–Η―²―¨ –¥–Ψ –Ϋ–Β–Ζ–Ϋ–Α―΅–Ϋ–Ψ–≥–Ψ –Ω–Ψ―à–Κ–Ψ–¥–Ε–Β–Ϋ–Ϋ―è ―²–Κ–Α–Ϋ–Η–Ϋ–Η βÄî ―Ä–Ψ–Ζ–≤–Η–≤–Α―î―²―¨―¹―è –Μ–Ψ–Κ–Α–Μ―¨–Ϋ–Η–Ι –Ζ–Α–Ω–Α–Μ―¨–Ϋ–Η–Ι –Ω―Ä–Ψ―Ü–Β―¹. –Θ―à–Κ–Ψ–¥–Ε–Β–Ϋ–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η –≤–Η–¥―•–Μ―è―é―²―¨ ―Ö–Β–Φ–Ψ–Κ―•–Ϋ–Η , ―²–Ψ–Φ―É –¥–Ψ –Ϋ–Η―Ö –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―é―²―¨―¹―è –Φ–Α–Κ―Ä–Ψ―³–Α–≥–Η, –Μ―•–Φ―³–Ψ―Ü–Η―²–Η ―²–Α –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η. –½–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü―•―½ ―•–Φ―É–Ϋ–Ϋ–Η―Ö –Κ–Μ―•―²–Η–Ϋ ―É –Φ―•―¹―Ü―• –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –≤–Α–Κ―Ü–Η–Ϋ–Η –Ω―•–¥–≤–Η―â―É―î ―½―½ –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨[ 21]
–Γ–Ψ–Ϋ–Ψ–Ω–Ψ―Ä–Α―Ü―•―è βÄî –Φ–Β―²–Ψ–¥ –Ω–Β―Ä–Β–Ϋ–Β―¹–Β–Ϋ–Ϋ―è ―΅―É–Ε–Ψ―Ä―•–¥–Ϋ–Ψ―½ –î–ù–ö –≤ –Κ–Μ―•―²–Η–Ϋ–Η –Ζ–Α –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é ―É–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ―É . –Θ–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ –Ζ–±―•–Μ―¨―à―É―î –Ω―Ä–Ψ–Ϋ–Η–Κ–Ϋ―•―¹―²―¨ –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½ –Φ–Β–Φ–±―Ä–Α–Ϋ–Η, –≤–Ϋ–Α―¹–Μ―•–¥–Ψ–Κ ―΅–Ψ–≥–Ψ –Β–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ–Α –î–ù–ö –Μ–Β–≥―à–Β –Ω―Ä–Ψ–Ϋ–Η–Κ–Α―î –≤ –Κ–Μ―•―²–Η–Ϋ―É. –£–Ω–Β―Ä―à–Β ―¹–Ψ–Ϋ–Ψ–Ω–Ψ―Ä–Α―Ü―•―è –¥–Μ―è –Ω–Β―Ä–Β–Ϋ–Β―¹–Β–Ϋ–Ϋ―è –≥–Β–Ϋ―•–≤ –≤ –Κ–Μ―•―²–Η–Ϋ―É –±―É–Μ–Α –Ζ–Α―¹―²–Ψ―¹–Ψ–≤–Α–Ϋ–Α –≤ 1986 ―Ä–Ψ―Ü―•[ 22] ―Ä–Ψ–≥―•–≤–Κ–Η , –Φ–Ψ–Ζ–Κ―É, –Κ―•―¹―²–Κ–Ψ–≤–Ψ―½ ―²–Κ–Α–Ϋ–Η–Ϋ–Η, –Ϋ–Η―Ä–Ψ–Κ, –Ω―•–¥―à–Μ―É–Ϋ–Κ–Ψ–≤–Ψ―½ –Ζ–Α–Μ–Ψ–Ζ–Η, –Β–Φ–±―Ä―•–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ―½ ―²–Κ–Α–Ϋ–Η–Ϋ–Η, ―¹–Κ–Β–Μ–Β―²–Ϋ–Η―Ö ―• ―¹–Β―Ä―Ü–Β–≤–Ψ–≥–Ψ –Φ'―è–Ζ―•–≤. –£―•–¥–Ϋ–Ψ―¹–Ϋ–Ψ ―•–Ϋ―à–Η―Ö –Φ–Β―²–Ψ–¥―•–≤ ―¹–Ψ–Ϋ–Ψ–Ω–Ψ―Ä–Α―Ü―•―è ―î –Φ–Α–Μ–Ψ–¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ–Ψ―é, –Ϋ–Β–Ψ–±―Ö―•–¥–Ϋ–Ψ ―â–Β ―΅–Η–Φ–Α–Μ–Ψ –Ζ―É―¹–Η–Μ―¨, ―â–Ψ–± –Ω―•–¥–≤–Η―â–Η―²–Η ―½―½ –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨, –Ψ―¹–Ψ–±–Μ–Η–≤–Ψ –Ϋ–Α ―Ä―•–≤–Ϋ―• ―Ü―•–Μ–Ψ–≥–Ψ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ―É[ 16]
–ë–Α–Μ―•―¹―²–Η―΅–Ϋ–Α ―²―Ä–Α–Ϋ―¹―³–Β–Κ―Ü―•―è “ë―Ä―É–Ϋ―²―É―î―²―¨―¹―è –Ϋ–Α –Ψ–±―¹―²―Ä―•–Μ―é–≤–Α–Ϋ–Ϋ―• (–±–Ψ–Φ–±–Α―Ä–¥―É–≤–Α–Ϋ–Ϋ―•) –Ψ―Ä–≥–Α–Ϋ―•–≤ ―• ―²–Κ–Α–Ϋ–Η–Ϋ –Φ―•–Κ―Ä–Ψ―΅–Α―¹―²–Η–Ϋ–Κ–Α–Φ–Η –≤–Α–Ε–Κ–Η―Ö –Φ–Β―²–Α–Μ―•–≤ (–Ζ–Ψ–Μ–Ψ―²–Ψ , –≤–Ψ–Μ―¨―³―Ä–Α–Φ ) –¥―•–Α–Φ–Β―²―Ä–Ψ–Φ 1-3 –Φ–Κ–Φ –Ω–Ψ–Κ―Ä–Η―²–Η―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ–Α–Φ–Η –î–ù–ö. –£–≤–Β–¥–Β–Ϋ–Α ―²–Α–Κ–Η–Φ ―΅–Η–Ϋ–Ψ–Φ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α –Β–Κ―¹–Ω―Ä–Β―¹―É―î―²―¨―¹―è –≤ –Κ–Μ―•―²–Η–Ϋ–Α―Ö-–Φ―•―à–Β–Ϋ―è―Ö, –Α ―½―Ö–Ϋ―• –Ω―Ä–Ψ–¥―É–Κ―²–Η –Ω–Ψ―²―Ä–Α–Ω–Μ―è―é―²―¨ ―É –Κ―Ä–Ψ–≤. –î–Μ―è –Ϋ–Α–¥–Α–Ϋ–Ϋ―è –Ω―Ä–Η―¹–Κ–Ψ―Ä–Β–Ϋ–Ϋ―è ―΅–Α―¹―²–Η–Ϋ–Κ–Α–Φ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨―¹―è ―¹―Ö–Ψ–Ε–Η–Ι –Ϋ–Α ―¹―²―Ä―•–Μ–Β―Ü―¨–Κ―É –Ζ–±―Ä–Ψ―é –Ω―Ä–Η―¹―²―Ä―•–Ι βÄî –≥–Β–Ϋ–Ϋ–Η–Ι –Ω―•―¹―²–Ψ–Μ–Β―² –Α–±–Ψ –≥–Β–Ϋ–Ϋ―É –≥–Α―Ä–Φ–Α―²―É. –€―•–Κ―Ä–Ψ―΅–Α―¹―²–Η–Ϋ–Κ–Η –Ω―Ä–Ψ―Ö–Ψ–¥―è―²―¨ ―΅–Β―Ä–Β–Ζ –Κ–Μ―•―²–Η–Ϋ–Ϋ―• –Φ–Β–Φ–±―Ä–Α–Ϋ–Η ―• –Ω–Β―Ä–Β–Ϋ–Ψ―¹―è―²―¨ –≥–Β–Ϋ–Β―²–Η―΅–Ϋ―É –Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―é –±–Β–Ζ–Ω–Ψ―¹–Β―Ä–Β–¥–Ϋ―¨–Ψ ―É ―è–¥―Ä–Ψ –Κ–Μ―•―²–Η–Ϋ–Η. –™–Μ–Η–±–Η–Ϋ–Α –Ω―Ä–Ψ–Ϋ–Η–Κ–Ϋ–Β–Ϋ–Ϋ―è –Φ―•–Κ―Ä–Ψ―΅–Α―¹―²–Ψ–Κ, ―è–Κ –Ω―Ä–Α–≤–Η–Μ–Ψ, –Ϋ–Β–≤–Β–Μ–Η–Κ–Α βÄî –¥–Ψ 1 –Φ–Φ, ―²–Ψ–Φ―É –Φ–Β―²–Ψ–¥ –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É―é―²―¨ –Ω–Β―Ä–Β–≤–Α–Ε–Ϋ–Ψ –¥–Μ―è ―²―Ä–Α–Ϋ―¹―³–Β–Κ―Ü―•―½ ―à–Κ―•―Ä–Η –Α–±–Ψ –Ω―Ä–Η–Μ–Β–≥–Μ–Ψ―½ ―Ö―Ä―è―â–Ψ–≤–Ψ―½ ―²–Κ–Α–Ϋ–Η–Ϋ–Η. –û―¹–Ψ–±–Μ–Η–≤―• ―É–Φ–Ψ–≤–Η –Ψ–±―¹―²―Ä―•–Μ―É –¥–Ψ–Ζ–≤–Ψ–Μ―è―é―²―¨ –Φ―•–Κ―Ä–Ψ―΅–Α―¹―²–Η–Ϋ–Κ–Α–Φ –Ω―Ä–Ψ–Ϋ–Η–Κ–Α―²–Η –Ϋ–Α –≥–Μ–Η–±–Η–Ϋ―É –¥–Ψ 4-5 –Φ–Φ ―• –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η―²–Η –≥–Β–Ϋ–Ϋ―• –Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―½ ―É –≤–Ψ–Μ–Ψ–Κ–Ϋ–Α –Ω–Ψ–Ω–Β―Ä–Β―΅–Ϋ–Ψ-―¹–Φ―É–≥–Α―¹―²–Η―Ö –Φ'―è–Ζ―•–≤. –½–Α–Ζ–≤–Η―΅–Α–Ι –Κ–Μ―•―²–Η–Ϋ–Η, ―â–Ψ –Ζ–Ϋ–Α―Ö–Ψ–¥―è―²―¨―¹―è –±–Β–Ζ–Ω–Ψ―¹–Β―Ä–Β–¥–Ϋ―¨–Ψ –Ω–Ψ ―Ü–Β–Ϋ―²―Ä―É –Ω–Ψ―¹―²―Ä―•–Μ―É, –≥–Η–Ϋ―É―²―¨, –≤ ―²–Ψ–Ι ―΅–Α―¹ –Κ–Ψ–Μ–Η –≤ –Ζ–Ψ–Ϋ―• 0,6-1 ―¹–Φ –≤―•–¥ ―Ü–Β–Ϋ―²―Ä―É –Ζ–Ϋ–Α―Ö–Ψ–¥―è―²―¨―¹―è –Ϋ–Α–Ι–±―•–Μ―¨―à –≤–¥–Α–Μ–Ψ –Ω―Ä–Ψ―²―Ä–Α–Ϋ―¹―³–Ψ―Ä–Φ–Ψ–≤–Α–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η. –Π―é ―²–Β―Ö–Ϋ–Ψ–Μ–Ψ–≥―•―é –Ϋ–Α–Ζ–Η–≤–Α―é―²―¨ ―²–Α–Κ–Ψ–Ε –±―•–Ψ–±–Α–Μ―•―¹―²–Η–Κ–Ψ―é –Α–±–Ψ –±―•–Ψ–Μ―•―¹―²–Η–Κ–Ψ―é[ 23]
–ü–Β―Ä―à–Η–Ι –≥–Β–Ϋ–Ϋ–Η–Ι –Ω―•―¹―²–Ψ–Μ–Β―² –±―É–≤ ―¹―²–≤–Ψ―Ä–Β–Ϋ–Η–Ι –≥―Ä―É–Ω–Ψ―é –≤―΅–Β–Ϋ–Η―Ö ―É –Ω–Β―Ä―•–Ψ–¥ 1983 ―²–Α 1986 ―Ä–Ψ–Κ–Α–Φ–Η –Ζ –Φ–Β―²–Ψ―é ―²―Ä–Α–Ϋ―¹―³–Ψ―Ä–Φ–Α―Ü―•―½ –Κ–Μ―•―²–Η–Ϋ ―Ä–Ψ―¹–Μ–Η–Ϋ. –Π–Β –±―É–≤ –Ω―•―¹―²–Ψ–Μ–Β―², ―Ä–Ψ–Ζ―Ä–Ψ–±–Μ–Β–Ϋ–Η–Ι –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –Ω―Ä–Η―¹―²―Ä–Ψ―é, –¥–Μ―è –Α–≤―²–Ψ–Φ–Α―²–Η―΅–Ϋ–Ψ–≥–Ψ –Ζ–Α–±–Η–≤–Α–Ϋ–Ϋ―è ―Ü–≤―è―Ö―•–≤. –ù–Α –≤–Ψ–Μ―¨―³―Ä–Α–Φ–Ψ–≤―É –Κ―É–Μ―é –Ϋ–Α–Ϋ–Ψ―¹–Η–Μ–Η –î–ù–ö –Ζ ―Ä–Β–Ω–Ψ―Ä―²–Β―Ä–Ϋ–Η–Φ (–Φ–Α―Ä–Κ–Β―Ä–Ϋ–Η–Φ) –≥–Β–Ϋ–Ψ–Φ ―• –≤–Η―¹―²―Ä―•–Μ―é–≤–Α–Μ–Η –Ϋ–Β―é –≤ ―΅–Α―à–Κ―É –ü–Β―²―Ä―• . –ï–Κ―¹–Ω―Ä–Β―¹―•―è ―Ä–Β–Ω–Ψ―Ä―²–Β―Ä–Ϋ–Ψ–≥–Ψ –≥–Β–Ϋ―É ―¹–≤―•–¥―΅–Η–Μ–Α –Ω―Ä–Ψ –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ ―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½. –ù–Α ―¹―¨–Ψ–≥–Ψ–¥–Ϋ―• –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η –î–ù–ö –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ ―΅–Α―¹―²–Η–Ϋ–Κ–Η –Ζ –Ζ–Ψ–Μ–Ψ―²–Α ―΅–Η ―¹―Ä―•–±–Μ–Α, ―²–Α–Κ ―è–Κ –≤–Ψ–Ϋ–Η ―î –Ϋ–Β ―²–Ψ–Κ―¹–Η―΅–Ϋ–Η–Φ–Η –¥–Μ―è –Κ–Μ―•―²–Η–Ϋ–Η, –Ϋ–Α –≤―•–¥–Φ―•–Ϋ―É –≤―•–¥ –≤–Ψ–Μ―¨―³―Ä–Α–Φ–Ψ–≤–Η―Ö[ 24]
–£ 1999 ―Ä–Ψ―Ü―• –±―É–Μ–Η ―Ä–Ψ–Ζ―Ä–Ψ–±–Μ–Β–Ϋ―• ―•–Ϋ'―î–Κ―Ü―•–Ι–Ϋ―• –Ω―Ä–Η–Μ–Α–¥–Η, ―è–Κ―• –Ζ–¥–Α―²–Ϋ―• –≤–≤–Ψ–¥–Η―²–Η –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ―É –±–Β–Ζ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –≥–Ψ–Μ–Κ–Η[ 25] ―¹–Η–Μ―• –¦–Ψ―Ä–Β–Ϋ―Ü–Α : –Ϋ–Β–≤–Β–Μ–Η–Κ–Η–Ι –Ω–Ψ―²―É–Ε–Ϋ–Η–Ι –Φ–Α–≥–Ϋ―•―² ―¹―²–≤–Ψ―Ä―é―î –Ζ–Ϋ–Α―΅–Ϋ–Η–Ι ―²–Η―¹–Κ, –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨ –≤ –¥―•―é –Ω–Ψ―Ä―à–Β–Ϋ―¨, ―è–Κ–Η–Ι –≤–Η–Κ–Η–¥–Α―î –Μ―•–Κ–Α―Ä―¹―¨–Κ–Η–Ι –Ω―Ä–Β–Ω–Α―Ä–Α―² –Ζ―• ―à–≤–Η–¥–Κ―•―¹―²―é –Ζ–≤―É–Κ―É[ 16] [ 26] [ 27] [ 28]
–•–Η–≤―• –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―• –≤–Β–Κ―²–Ψ―Ä–Η βÄî ―Ü–Β ―à―²–Α–Φ–Η Salmonela , Shigella –Α–±–Ψ Listeria , ―è–Κ―• –Ϋ–Β―¹―É―²―¨ –Φ―É―²–Α―Ü―•―é –≤ –≥–Β–Ϋ–Α―Ö –±―•–Ψ―¹–Η–Ϋ―²–Β–Ζ―É –Α–±–Ψ ―•–Ϋ–≤–Α–Ζ―•―½, ―â–Ψ ―É―¹―É–≤–Α―î ―½―Ö –Ω–Α―²–Ψ–≥–Β–Ϋ–Ϋ―•―¹―²―¨ ―• –Ζ–¥–Α―²–Ϋ―•―¹―²―¨ –Ζ–±–Β―Ä―•–≥–Α―²–Η ―¹–≤–Ψ―é –Ε–Η―²―²―î–Ζ–¥–Α―²–Ϋ―•―¹―²―¨ –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ―• –≥–Ψ―¹–Ω–Ψ–¥–Α―Ä―è ―΅–Η –Ϋ–Α–≤–Κ–Ψ–Μ–Η―à–Ϋ―¨–Ψ–Φ―É ―¹–Β―Ä–Β–¥–Ψ–≤–Η―â―•. –ù–Α―²–Ψ–Φ―•―¹―²―¨ –≤ –≥–Β–Ϋ–Ψ–Φ –±–Α–Κ―²–Β―Ä―•–Ι –≤–±―É–¥–Ψ–≤―É―é―²―¨ –Ω–Ψ―²―Ä―•–±–Ϋ―• –≥–Β–Ϋ–Η ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ–Η―Ö –Ω―Ä–Ψ―²–Β―½–Ϋ―•–≤. –û―¹–Μ–Α–±–Μ–Β–Ϋ–Α –±–Α–Κ―²–Β―Ä―•―è –≤–≤–Ψ–¥–Η―²―¨―¹―è –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ –Ω–Β―Ä–Ψ―Ä–Α–Μ―¨–Ϋ–Η–Φ ―à–Μ―è―Ö–Ψ–Φ (―΅–Β―Ä–Β–Ζ ―Ä–Ψ―², ―à–Μ―è―Ö–Ψ–Φ –Ω―Ä–Ψ–Κ–Ψ–≤―²―É–≤–Α–Ϋ–Ϋ―è) –Α–±–Ψ ―•–Ϋ―²―Ä–Ψ–Ϋ–Α–Ζ–Α–Μ―¨–Ϋ–Ψ (―à–Μ―è―Ö–Ψ–Φ –≤–Ω―Ä–Η―¹–Κ―É–≤–Α–Ϋ–Ϋ―è –≤ –Ϋ–Ψ―¹–Ψ–≤–Η–Ι –Ψ―²–≤―•―Ä), ―²–Ψ–Φ―É ―Ü–Β–Ι ―¹–Ω–Ψ―¹―•–± –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ –Ϋ–Β –Ω–Ψ―²―Ä–Β–±―É―î –Ε–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ψ–±–Μ–Α–¥–Ϋ–Α–Ϋ–Ϋ―è. –ö―Ä―•–Φ ―²–Ψ–≥–Ψ, ―²–Α–Κ–Β –≤–≤–Β–¥–Β–Ϋ–Ϋ―è ―¹―²–Η–Φ―É–Μ―é―î ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨ ―¹–Μ–Η–Ζ–Ψ–≤–Ψ―½ –Ψ–±–Ψ–Μ–Ψ–Ϋ–Κ–Η, ―â–Ψ –≤–Α–Ε–Μ–Η–≤–Ψ, –Ψ―¹–Κ―•–Μ―¨–Κ–Η –±―•–Μ―¨―à―•―¹―²―¨ –Ω–Α―²–Ψ–≥–Β–Ϋ―•–≤ –Ω–Ψ―²―Ä–Α–Ω–Μ―è―é―²―¨ –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ ―΅–Β―Ä–Β–Ζ ―Ä–Ψ―²–Ψ–≤–Η–Ι ―• –Ϋ–Α–Ζ–Α–Μ―¨–Ϋ–Η–Ι –Ψ―²–≤–Ψ―Ä–Η.
–€–Η–Ϋ–Α―é―΅–Η ―à–Μ―É–Ϋ–Ψ–Κ –Ψ―¹–Μ–Α–±–Μ–Β–Ϋ–Α –±–Α–Κ―²–Β―Ä―•―è –Ω–Ψ–Ω–Α–¥–Α―î –≤ ―²–Ψ–Ϋ–Κ–Η–Ι –Κ–Η―à–Β―΅–Ϋ–Η–Κ. –î–Α–Μ―• –±–Α–Κ―²–Β―Ä―•―è –Ω―Ä–Ψ–Ϋ–Η–Κ–Α―î –≤ –ü–Β―î―Ä–Ψ–≤―• –±–Μ―è―à–Κ–Η βÄî –Μ―•–Φ―³–Ψ–≤―É–Ζ–Μ–Η –Κ–Η―à–Β―΅–Ϋ–Η–Κ–Α. –û–Ω–Η–Ϋ–Η–≤―à–Η―¹―¨ –≤ ―¹–Β―Ä–Β–¥–Η–Ϋ―• –ü–Β–Ι―î―Ä–Ψ–≤–Η―Ö –±–Μ―è―à–Ψ–Κ, –±–Α–Κ―²–Β―Ä―•―½ ―¹―²–Α―é―²―¨ –Φ―•―à–Β–Ϋ–Ϋ―é –¥–Μ―è –Φ–Α–Κ―Ä–Ψ―³–Α–≥―•–≤ ―• –Ω―•–¥–¥–Α―é―²―¨―¹―è ―³–Α–≥–Ψ―Ü–Η―²–Ψ–Ζ―É . –£ ―Ü–Η―²–Ψ–Ω–Μ–Α–Ζ–Φ―• –Φ–Α–Κ―Ä–Ψ―³–Α–≥–Α –≤―•–¥–±―É–≤–Α―î―²―¨―¹―è –≤–Η–≤―•–Μ―¨–Ϋ–Β–Ϋ–Ϋ―è –±–Α–Κ―²–Β―Ä―•―î―é –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η, –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ –î–ù–ö –Ω–Ψ―²―Ä–Α–Ω–Μ―è―î –≤ ―è–¥―Ä–Ψ, –Α –±–Α–Κ―²–Β―Ä―•―è –Ζ–Ϋ–Β―à–Κ–Ψ–¥–Ε―É―î―²―¨―¹―è ―•–Φ―É–Ϋ–Ϋ–Ψ―é ―¹–Η―¹―²–Β–Φ–Ψ―é[ 18] [ 29]
–ë―É–¥–Ψ–≤–Α –Μ―•–Ω–Ψ―¹–Ψ–Φ–Η –Γ―Ö–Β–Φ–Α―²–Η―΅–Ϋ–Β –Ζ–Ψ–±―Ä–Α–Ε–Β–Ϋ–Ϋ―è –Μ―•–Ω–Ψ–Ω–Μ–Β–Κ―¹―É: ―΅–Β―Ä–≤–Ψ–Ϋ–Η–Φ –Κ–Ψ–Μ―¨–Ψ―Ä–Ψ–Φ –Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ―• –≥―•–¥―Ä–Ψ―³―•–Μ―¨–Ϋ―• –≥–Ψ–Μ–Ψ–≤–Κ–Η –Μ―•–Ω―•–¥―•–≤, ―¹―•―Ä–Η–Φ βÄî –Μ―•–Ω―•–¥–Ϋ―• ―Ö–≤–Ψ―¹―²–Η, ―¹–Η–Ϋ―•–Φ βÄî –Φ–Ψ–Μ–Β–Κ―É–Μ–Η –î–ù–ö. –¦―•–Ω–Ψ―¹–Ψ–Φ–Α βÄî –Κ―É–Μ–Β–Ω–Ψ–¥―•–±–Ϋ–Β ―É―²–≤–Ψ―Ä–Β–Ϋ–Ϋ―è (–±–Μ–Η–Ζ―¨–Κ–Ψ 100 –Ϋ–Φ ―É –¥―•–Α–Φ–Β―²―Ä―•), ―â–Ψ ―¹–Κ–Μ–Α–¥–Α―î―²―¨―¹―è –Ζ –Ω–Ψ–¥–≤―•–Ι–Ϋ–Ψ–≥–Ψ –Μ―•–Ω―•–¥–Ϋ–Ψ–≥–Ψ ―à–Α―Ä―É. –¦―•–Ω–Ψ―¹–Ψ–Φ–Η –Φ–Α―é―²―¨ –Ω–Ψ―Ä–Ψ–Ε–Ϋ–Η–Ϋ―É –≤―¹–Β―Ä–Β–¥–Η–Ϋ―•, ―è–Κ–Α –Ζ–Α–Ζ–≤–Η―΅–Α–Ι –Ζ–Α–Ω–Ψ–≤–Ϋ–Β–Ϋ–Α ―Ä–Ψ–Ζ―΅–Η–Ϋ–Ϋ–Η–Κ–Ψ–Φ , –Α–Μ–Β –Φ–Ψ–Ε–Β –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É–≤–Α―²–Η―¹―¨ –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η ―Ä―•–Ζ–Ϋ–Ψ–Φ–Α–Ϋ―•―²–Ϋ–Η―Ö ―Ä–Β―΅–Ψ–≤–Η–Ϋ, –≤ ―²–Ψ–Φ―É ―΅–Η―¹–Μ―• ―• –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ. –΅―Ö –≥―•–¥―Ä–Ψ―³–Ψ–±–Ϋ–Α –Ψ–±–Ψ–Μ–Ψ–Ϋ–Κ–Α –¥–Ψ–Ζ–≤–Ψ–Μ―è―î ―½–Φ –Ζ–Μ–Η–≤–Α―²–Η―¹―¨ –Ζ –Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Φ–Η –Φ–Β–Φ–±―Ä–Α–Ϋ–Α–Φ–Η ―• –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η―²–Η ―¹–≤―•–Ι –≤–Φ―•―¹―² ―É―¹–Β―Ä–Β–¥–Η–Ϋ―É –Κ–Μ―•―²–Η–Ϋ–Η. –£–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –Μ―•–Ω–Ψ―¹–Ψ–Φ ―Ä–Ψ–Ζ–Ω–Ψ―΅–Α–Μ–Ψ―¹―è –≤ 1965 ―Ä., ―• ―Ü–Β ―¹―²–Α–Μ–Ψ –Ω–Ψ―²―É–Ε–Ϋ–Η–Φ –¥–≤–Η–≥―É–Ϋ–Ψ–Φ ―Ä–Ψ–Ζ–≤–Η―²–Κ―É –±―•–Ψ–Ϋ–Α–Ϋ–Ψ―²–Β―Ö–Ϋ–Ψ–Μ–Ψ–≥―•–Ι[ 30]
–ü–Β―Ä―¹–Ω–Β–Κ―²–Η–≤–Ϋ–Η–Φ ―¹–Ω–Ψ―¹–Ψ–±–Ψ–Φ –Ω―Ä―è–Φ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –î–ù–ö-–Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―½ –≤ –Κ–Μ―•―²–Η–Ϋ–Η-–Φ―•―à–Β–Ϋ―• ―î –¥–Ψ―¹―²–Α–≤–Κ–Α –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Ψ―½ –Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―½ –≤ ―¹–Κ–Μ–Α–¥―• –Κ–Α―²―•–Ψ–Ϋ–Ϋ–Η―Ö –Μ―•–Ω–Ψ―¹–Ψ–Φ, –Ω–Ψ–±―É–¥–Ψ–≤–Α–Ϋ–Η―Ö –Ζ –Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Η―Ö –Μ―•–Ω―•–¥―•–≤. –ö–Α―²―•–Ψ–Ϋ–Ϋ―• –Μ―•–Ω–Ψ―¹–Ψ–Φ–Η ―•–Ζ –Ϋ–Β–≥–Α―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Ψ―é –Φ–Ψ–Μ–Β–Κ―É–Μ–Ψ―é –î–ù–ö ―É―²–≤–Ψ―Ä―é―é―²―¨ –î–ù–ö-–Μ―•–Ω―•–¥–Ϋ–Η–Ι –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ βÄî –Μ―•–Ω–Ψ–Ω–Μ–Β–Κ―¹. –ü–Β―Ä–Β–≤–Α–≥–Η –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è ―²–Α–Κ–Η―Ö –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―•–≤ βÄî –Ζ–¥–Α―²–Ϋ―•―¹―²―¨ –Ϋ–Β―¹―²–Η –≤–Β–Μ–Η–Κ–Η–Ι –Ψ–±'―î–Φ ―•–Ϋ―³–Ψ―Ä–Φ–Α―Ü―•―½, –Ϋ–Β―•–Ϋ―³–Β–Κ―Ü―•–Ι–Ϋ―•―¹―²―¨, –Κ―Ä―•–Φ ―²–Ψ–≥–Ψ, –≤–Ψ–Ϋ–Η –Ω―Ä–Ψ―¹―²―• –Ι –Ϋ–Β–¥–Ψ―Ä–Ψ–≥―• ―É –≤–Η–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ―•[ 31] –Ω–Ψ–Μ―•–Φ–Β―Ä–Ψ–Φ –Ω–Ψ–Μ―•–Β―²–Η–Μ–Β–Ϋ–≥–Μ―•–Κ–Ψ–Μ–Β–Φ, ―è–Κ―• –Ζ–¥–Α―²–Ϋ―• –Ω―Ä–Ψ–Ϋ–Ψ―¹–Η―²–Η ―²–Β―Ä–Α–Ω–Β–≤―²–Η―΅–Ϋ―É –î–ù–ö –Κ―Ä―•–Ζ―¨ –≥–Β–Φ–Α―²–Ψ-–Β–Ϋ―Ü–Β―³–Α–Μ―•―΅–Ϋ–Η–Ι –±–Α―Ä'―î―Ä ―• –¥–Ψ―¹―²–Α–≤–Μ―è―²–Η ―½―½ –≤ –Ϋ–Β–Ι―Ä–Ψ–Ϋ–Η –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–Κ―É, ―â–Ψ –¥–Ψ ―Ü―¨–Ψ–≥–Ψ –±―É–Μ–Ψ –Ϋ–Β–Φ–Ψ–Ε–Μ–Η–≤–Η–Φ[ 32]
–î–Μ―è –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –≤ –Κ–Μ―•―²–Η–Ϋ―É –î–ù–ö-–Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•–Ι –≤–Β–Μ–Η–Κ–Η―Ö ―Ä–Ψ–Ζ–Φ―•―Ä―•–≤ (>10 ―².–Ω.–Ϋ.) –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹–Η βÄî ―¹–Η―¹―²–Β–Φ–Η, ―â–Ψ ―¹–Κ–Μ–Α–¥–Α―é―²―¨―¹―è –Ζ –Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Η―Ö –Ω–Ψ–Μ―•–Φ–Β―Ä―•–≤ (–Ω–Ψ–Μ―•–Κ–Α―²―•–Ψ–Ϋ―•–≤) ―• –Ϋ–Β–≥–Α―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Η―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ –î–ù–ö. –†–Ψ–Ζ–Φ―•―Ä ―²–Α–Κ–Η―Ö –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―•–≤ ―¹–Κ–Μ–Α–¥–Α―î –Φ–Β–Ϋ―à–Β 100 –Ϋ–Φ, ―â–Ψ, –Ζ –Ψ–¥–Ϋ―•―î―½ ―¹―²–Ψ―Ä–Ψ–Ϋ–Η, –Ϋ–Β –Ϋ–Α―Ä–Α–Ε–Α―î ―½―Ö –Ϋ–Α –Ω–Β―Ä–Β―²―Ä–Α–≤–Μ–Β–Ϋ–Ϋ―è –Φ–Α–Κ―Ä–Ψ―³–Α–≥–Α–Φ–Η (–Ψ―¹–Κ―•–Μ―¨–Κ–Η –≤–Ψ–Ϋ–Η ―Ä–Β–Α–≥―É―é―²―¨ –Ϋ–Α ―΅–Α―¹―²–Η–Ϋ–Κ–Η –±―•–Μ―¨―à–Β 200 –Ϋ–Φ), –Α –Ζ ―•–Ϋ―à–Ψ–≥–Ψ –±–Ψ–Κ―É, –≤–Ψ–Ϋ–Η –¥–Ψ―¹–Η―²―¨ –≤–Β–Μ–Η–Κ―•, ―â–Ψ–± –Ϋ–Β ―³―•–Μ―¨―²―Ä―É–≤–Α―²–Η―¹―¨ –≤ –Ϋ–Η―Ä–Κ–Α―Ö[ 33]
–ü–Ψ–Μ―•–Κ–Α―²―•–Ψ–Ϋ–Η –Κ–Ψ–Ϋ–¥–Β–Ϋ―¹―É―é―²―¨ –Φ–Ψ–Μ–Β–Κ―É–Μ―É –î–ù–ö –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Η, ―²–Α–Κ–Η–Φ ―΅–Η–Ϋ–Ψ–Φ –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―é―²―¨ ―½―½ ―¹―²–Α–±―•–Μ―¨–Ϋ―•―¹―²―¨ ―• –Ζ–Α―Ö–Η―¹―² –≤―•–¥ –¥―•―½ –Ϋ―É–Κ–Μ–Β–Α–Ζ . –·–Κ –î–ù–ö-–Ζ–≤―è–Ζ―É―é―΅―• –Ω–Ψ–Μ―•–Φ–Β―Ä–Η –Φ–Ψ–Ε―É―²―¨ ―¹–Μ―É–Ε–Η―²–Η –Κ–Α―²―•–Ψ–Ϋ–Ϋ―• –±―•–Μ–Κ–Η, ―¹–Η–Ϋ―²–Β―²–Η―΅–Ϋ―• –≥–Ψ–Φ–Ψ–Ω–Ψ–Μ―•–Φ–Β―Ä–Η –Α–Φ―•–Ϋ–Ψ–Κ–Η―¹–Μ–Ψ―² (–Ω–Ψ–Μ―•–Μ―•–Ζ–Η–Ϋ–Η, –Ω–Ψ–Μ―•–Α―Ä–≥―•–Ϋ―•–Ϋ–Η), –Ω–Ψ–Μ―•―¹–Α―Ö–Α―Ä–Η–¥ ―Ö―•―²–Ψ–Ζ–Α–Ϋ, –Ω–Ψ–Μ―•–Β―²–Η–Μ–Β–Ϋ–Α–Φ―•–Ϋ. –½–Α–Ζ–≤–Η―΅–Α–Ι –≤ ―¹–Κ–Μ–Α–¥―• –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹―•–≤ –Ω–Ψ–Μ―•–Κ–Α―²―•–Ψ–Ϋ –Ζ–Ϋ–Α―Ö–Ψ–¥–Η―²―¨―¹―è –≤ –Ϋ–Α–¥–Μ–Η―à–Κ―É, –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―• ―΅–Ψ–≥–Ψ –¥–Α–Ϋ–Η–Ι –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ ―î ―Ä–Ψ–Ζ―΅–Η–Ϋ–Ϋ–Η–Φ ―²–Α –Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Ψ –Ζ–Α―Ä―è–¥–Ε–Β–Ϋ–Η–Φ. –·–Κ―â–Ψ –¥–Ψ –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹―É –Ω―Ä–Η―à–Η―²–Η –Μ―•–≥–Α–Ϋ–¥ –¥–Ψ –Ω–Β–≤–Ϋ–Ψ–≥–Ψ –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ–≥–Ψ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α, ―²–Ψ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ―É –Φ–Ψ–Ε–Ϋ–Α –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―²–Η –≤ –Κ–Ψ–Ϋ–Κ―Ä–Β―²–Ϋ–Η–Ι ―²–Η–Ω –Κ–Μ―•―²–Η–Ϋ.
–ü―Ä–Ψ―Ü–Β―¹ –¥–Ψ―¹―²–Α–≤–Κ–Η –≥–Β–Ϋ–Β―²–Η―΅–Ϋ–Ψ–≥–Ψ –Φ–Α―²–Β―Ä―•–Α–Μ―É –≤ ―¹–Κ–Μ–Α–¥―• –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹―•–≤ –≤–Κ–Μ―é―΅–Α―î –¥–≤–Α –Β―²–Α–Ω–Η: –Ω–Ψ–Ζ–Α–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι (―à–Μ―è―Ö –≤―•–¥ –Φ―•―¹―Ü―è –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –¥–Ψ –Κ–Μ―•―²–Η–Ϋ-–Φ―•―à–Β–Ϋ–Β–Ι) ―• –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι (–≤–Ζ–Α―î–Φ–Ψ–¥―•―è –Ζ –Κ–Μ―•―²–Η–Ϋ–Α–Φ–Η-–Φ―•―à–Β–Ϋ–Β–Ι, –Β–Ϋ–¥–Ψ―Ü–Η―²–Ψ–Ζ , –≤–Η―Ö―•–¥ ―•–Ζ –Β–Ϋ–¥–Ψ―¹–Ψ–Φ , –¥–Ψ―¹―²–Α–≤–Κ–Α –≤ ―è–¥―Ä–Ψ ). –ü–Β―Ä―à–Η–Φ –±–Α―Ä'―î―Ä–Ψ–Φ, ―è–Κ–Η–Ι –Ϋ–Β–Ψ–±―Ö―•–¥–Ϋ–Ψ –Ω–Ψ–¥–Ψ–Μ–Α―²–Η –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―É, ―î –Κ―Ä–Ψ–≤ ―• –Ω–Ψ–Ζ–Α–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι –Φ–Α―²―Ä–Η–Κ―¹ . –Δ–Ψ–Φ―É –Ω―•–¥–±–Η―Ä–Α―é―²―¨―¹―è ―²–Α–Κ―• ―³―•–Ζ–Η–Κ–Ψ-―Ö―•–Φ―•―΅–Ϋ―• –Ω–Α―Ä–Α–Φ–Β―²―Ä–Η –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹―É, ―â–Ψ–± –Ζ–±―•–Μ―¨―à–Η―²–Η –Ι–Ψ–≥–Ψ ―¹―²–Α–±―•–Μ―¨–Ϋ―•―¹―²―¨, ―É–Ϋ–Η–Κ–Ϋ―É―²–Η –Ϋ–Β–±–Α–Ε–Α–Ϋ–Η―Ö –≤–Ζ–Α―î–Φ–Ψ–¥―•–Ι –Ζ –±―•–Μ–Κ–Α–Φ–Η –Κ―Ä–Ψ–≤―• ―²–Α ―•–Φ―É–Ϋ–Ϋ–Ψ―½ ―Ä–Β–Α–Κ―Ü―•―½, –≤–Η–Κ–Μ–Η–Κ–Α–Ϋ–Ψ―½ ―Ö―•–Φ―•―΅–Ϋ–Ψ―é –Ω―Ä–Η―Ä–Ψ–¥–Ψ―é –Ω–Ψ–Μ―•–Κ–Α―²―•–Ψ–Ϋ―É. –ü–Ψ―²―Ä–Α–Ω–Η–≤―à–Η –¥–Ψ –Κ–Μ―•―²–Η–Ϋ–Η-–Φ―•―à–Β–Ϋ―•, –Ω–Ψ–Μ―•–Ω–Μ–Β–Κ―¹ –Α–¥―¹–Ψ―Ä–±―É―î―²―¨―¹―è –Ϋ–Α –Ω–Μ–Α–Ζ–Φ–Α―²–Η―΅–Ϋ―•–Ι –Φ–Β–Φ–±―Ä–Α–Ϋ―•, –Ω–Ψ–≥–Μ–Η–Ϋ–Α―î―²―¨―¹―è ―à–Μ―è―Ö–Ψ–Φ –Β–Ϋ–¥–Ψ―Ü–Η―²–Ψ–Ζ―É, –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ –≤―•–Ϋ –Ω–Ψ–≤–Η–Ϋ–Β–Ϋ –Ω–Ψ–Κ–Η–Ϋ―É―²–Η –Β–Ϋ–¥–Ψ―¹–Ψ–Φ―É ―• –¥–Η―¹–Ψ―Ü―•―é–≤–Α―²–Η –Ϋ–Α –Κ–Α―²―•–Ψ–Ϋ–Ϋ–Η–Ι –Ω–Ψ–Μ―•–Φ–Β―Ä ―• –Φ–Ψ–Μ–Β–Κ―É–Μ―É –î–ù–ö. –£―•–Μ―¨–Ϋ–Α –î–ù–ö –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―î―²―¨―¹―è –≤ ―è–¥―Ä–Ψ, –Α –Κ–Α―²―•–Ψ–Ϋ–Ϋ–Η–Ι –Ω–Ψ–Μ―•–Φ–Β―Ä –Ω–Ψ–Κ–Η–¥–Α―î –Κ–Μ―•―²–Η–Ϋ―É ―• –≤–Η–≤–Ψ–¥–Η―²―¨―¹―è –Ζ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ―É[ 34]
–Ξ–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α –Ϋ–Α–Ι–±―•–Μ―¨―à –Ω–Ψ―à–Η―Ä–Β–Ϋ–Η―Ö –Φ–Β―²–Ψ–¥―•–≤ –¥–Ψ―¹―²–Α–≤–Κ–Η –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ[ 18] [ 16]
–€–Β―²–Ψ–¥
–ü–Β―Ä–Β–≤–Α–≥–Η
–ù–Β–¥–Ψ–Μ―•–Κ–Η
–£–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤―• –Α–±–Ψ –Ω―•–¥―à–Κ―•―Ä–Ϋ―• ―•–Ϋ'―î–Κ―Ü―•―½
–ù–Β –Ω–Ψ―²―Ä―•–±–Ϋ–Ψ ―¹–Ω–Β―Ü―•–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ψ–±–Μ–Α–¥–Ϋ–Α–Ϋ–Ϋ―è
–ü–Ψ―¹―²―•–Ι–Ϋ–Α –Α–±–Ψ –¥–Ψ–≤–≥–Ψ―²―Ä–Η–≤–Α–Μ–Α –Β–Κ―¹–Ω―Ä–Β―¹―•―è
–î–ù–ö ―Ä–Ψ–Ζ–Ϋ–Ψ―¹–Η―²―¨―¹―è –Ω–Ψ –Ω―Ä–Η–Μ–Β–≥–Μ–Η–Φ ―²–Κ–Α–Ϋ–Η–Ϋ–Α–Φ
–ù–Η–Ζ―¨–Κ–Α –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨
–ü–Ψ―²―Ä―•–±–Ϋ–Α –≤―•–¥–Ϋ–Ψ―¹–Ϋ–Ψ –≤–Β–Μ–Η–Κ–Α –Κ―•–Μ―¨–Κ―•―¹―²―¨ –î–ù–ö
–ï–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―è
–£–Η―¹–Ψ–Κ–Α –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨
–ü–Ψ―à–Κ–Ψ–¥–Ε–Β–Ϋ–Ϋ―è ―²–Κ–Α–Ϋ–Η–Ϋ
–™–Β–Ϋ–Ϋ–Η–Ι –Ω―•―¹―²–Ψ–Μ–Β―²
–£–Η―¹–Ψ–Κ–Α ―²–Ψ―΅–Ϋ―•―¹―²―¨
–ü–Ψ―²―Ä―•–±–Ϋ–Α –Ϋ–Β–≤–Β–Μ–Η–Κ–Α –Κ―•–Μ―¨–Κ―•―¹―²―¨ –î–ù–ö
–ü–Ψ―²―Ä–Β–±―É―î –Ϋ–Α―è–≤–Ϋ–Ψ―¹―²―• ―•–Ϋ–Β―Ä―²–Ϋ–Η―Ö –Φ―•–Κ―Ä–Ψ―΅–Α―¹―²–Η–Ϋ–Ψ–Κ
–ü–Ψ―à–Κ–Ψ–¥–Ε–Β–Ϋ–Ϋ―è –Κ–Μ―•―²–Η–Ϋ –≤ –Φ―•―¹―Ü―• –≤–Η―¹―²―Ä―•–Μ―É
–£–≤–Β–¥–Β–Ϋ–Ϋ―è –Ζ–Α ―Ä–Α―Ö―É–Ϋ–Ψ–Κ –≤–Η―¹–Ψ–Κ–Ψ–≥–Ψ ―²–Η―¹–Κ―É
–£―•–¥–Ϋ–Ψ―¹–Ϋ–Ψ –Ω―Ä–Ψ―¹―²–Η–Ι –Φ–Β―²–Ψ–¥
–£―•–¥―¹―É―²–Ϋ―è –Ω–Ψ―²―Ä–Β–±–Α –≤ –Φ―•–Κ―Ä–Ψ―΅–Α―¹―²–Η–Ϋ–Κ–Α―Ö
–î–ù–ö –Φ–Ψ–Ε–Β –Ω―Ä–Ψ–Ϋ–Η–Κ–Α―²–Η –Ϋ–Α –≥–Μ–Η–±–Η–Ϋ―É –≤―•–¥ –Κ―•–Μ―¨–Κ–Ψ―Ö –Φ–Φ –¥–Ψ 1,5 ―¹–Φ
–£–Ω–Μ–Η–≤–Α―î –Ϋ–Α ―¹―²―Ä―É–Κ―²―É―Ä―É –î–ù–ö
–ù–Η–Ζ―¨–Κ–Α –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ ―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½
–ü–Ψ―²―Ä–Β–±―É―î –≤–Β–Μ–Η–Κ–Ψ―½ –Κ―•–Μ―¨–Κ–Ψ―¹―²―• –î–ù–ö (–¥–Ψ 300 –Φ–Κ–≥)
–Θ–Ω–Α–Κ–Ψ–≤–Κ–Α –≤ –Μ―•–Ω–Ψ―¹–Ψ–Φ–Η
–£–Η―¹–Ψ–Κ–Α –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ in vitro
–ü―Ä–Ψ―¹―²–Ψ―²–Α –≤–Η–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ–Ϋ―è
–£–Β–Μ–Η–Κ–Α ―î–Φ–Ϋ―•―¹―²―¨
–€–Ψ–Ε–Ϋ–Α –Ω–Ψ―î–¥–Ϋ―É–≤–Α―²–Η –Ζ ―•–Ϋ―à–Η–Φ–Η –Φ–Β―²–Ψ–¥–Α–Φ–Η
–ü―Ä–Η –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–≤–Β–Ϋ–Ϋ–Ψ–Φ―É –≤–≤–Β–¥–Β–Ϋ–Ϋ―• –≤–Α–Κ―Ü–Η–Ϋ–Α –Ω–Ψ―²–Β–Ϋ―Ü―•–Ι–Ϋ–Ψ –Φ–Ψ–Ε–Β –Ω–Ψ―²―Ä–Α–Ω–Μ―è―²–Η –≤ ―É―¹―• ―²–Κ–Α–Ϋ–Η–Ϋ–Η
–Ü–Ϋ―²―Ä–Ψ–Ϋ–Α–Ζ–Α–Μ―¨–Ϋ–Β –≤–≤–Β–¥–Β–Ϋ–Ϋ―è –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―î –Β–Κ―¹–Ω―Ä–Β―¹―•―é –≤–Α–Κ―Ü–Η–Ϋ–Η –≤ ―¹–Μ–Η–Ζ–Ψ–≤―•–Ι –Ψ–±–Ψ–Μ–Ψ–Ϋ―Ü―• –Ϋ–Ψ―¹–Α ―• –≤–Η―Ä–Ψ–±–Μ–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ψ–≥–Μ–Ψ–±―É–Μ―•–Ϋ―•–≤ –Κ–Μ–Α―¹―É –ê (IgA)
–€–Ψ–Ε–Μ–Η–≤–Α ―²–Ψ–Κ―¹–Η―΅–Ϋ―•―¹―²―¨
–ù–Η–Ζ―¨–Κ–Α –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ in vivo
–Γ―Ö–Β–Φ–Α ―Ä–Ψ–Ζ–≤–Η―²–Κ―É ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –Ω―Ä–Η –î–ù–ö-―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½ –Γ–Η–Ϋ―²–Β–Ζ–Ψ–≤–Α–Ϋ–Η–Ι –≤ –Κ–Μ―•―²–Η–Ϋ―• –Α–Ϋ―²–Η–≥–Β–Ϋ –Ω―•–¥–¥–Α―î―²―¨―¹―è –Ω―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥―É, –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ –≤―•–¥–±―É–≤–Α―î―²―¨―¹―è –Ι–Ψ–≥–Ψ –Ω―Ä–Β–Ζ–Β–Ϋ―²–Α―Ü―•―è ―•–Φ―É–Ϋ–Ψ–Κ–Ψ–Φ–Ω–Β―²–Β–Ϋ―²–Ϋ–Η–Φ –Κ–Μ―•―²–Η–Ϋ–Α–Φ. –ü―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥ βÄî ―Ü–Β ―Ä–Ψ–Ζ―â–Β–Ω–Μ–Β–Ϋ–Ϋ―è –Α–Ϋ―²–Η–≥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―²–Β―½–Ϋ―É –Ϋ–Α ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ―• –Ω–Β–Ω―²–Η–¥–Ϋ―• ―³―Ä–Α–≥–Φ–Β–Ϋ―²–Η. –ü―Ä–Β–Ζ–Β–Ϋ―²–Α―Ü―•―è –Ψ–Ζ–Ϋ–Α―΅–Α―î –Ω–Ψ–¥–Α―΅―É ―³―Ä–Α–≥–Φ–Β–Ϋ―²–Α –Α–Ϋ―²–Η–≥–Β–Ϋ–Α ―¹–Ω–Ψ–Μ―É―΅–Β–Ϋ–Ψ–≥–Ψ –Ζ –Φ–Ψ–Μ–Β–Κ―É–Μ–Α–Φ–Η –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―É –≥―•―¹―²–Ψ―¹―É–Φ―•―¹–Ϋ–Ψ―¹―²―• (MHC) ―•–Φ―É–Ϋ–Ψ–Κ–Ψ–Φ–Ω–Β―²–Β–Ϋ―²–Ϋ–Η–Φ –Κ–Μ―•―²–Η–Ϋ–Α–Φ. –†–Ψ–Ζ―Ä―•–Ζ–Ϋ―è―é―²―¨ –¥–≤–Α –Ϋ–Α–Ι–±―•–Μ―¨―à –Ζ–Ϋ–Α―΅–Η–Φ–Η―Ö –Κ–Μ–Α―¹–Η ―Ü–Η―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ: –€–ù–Γ –Κ–Μ–Α―¹―É I (–€–ù–Γ-I) ―• –€–ù–Γ –Κ–Μ–Α―¹―É II (–€–ù–Γ-II). –î–Μ―è –Ζ–≤'―è–Ζ―É–≤–Α–Ϋ–Ϋ―è –Ζ –Φ–Ψ–Μ–Β–Κ―É–Μ–Α–Φ–Η –Κ–Ψ–Ε–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α―¹―É –Α–Ϋ―²–Η–≥–Β–Ϋ –Ω―Ä–Ψ―Ö–Ψ–¥–Η―²―¨ –Ω―•–¥–≥–Ψ―²–Ψ–≤–Κ―É –≤ ―¹–Ω–Β―Ü―•–Α–Μ―•–Ζ–Ψ–≤–Α–Ϋ–Η―Ö –Κ–Ψ–Φ–Ω–Α―Ä―²–Φ–Β–Ϋ―²–Α―Ö –Κ–Μ―•―²–Η–Ϋ–Η. –ï–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ―• –±―•–Μ–Κ–Η-–Α–Ϋ―²–Η–≥–Β–Ϋ–Η –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―é―²―¨―¹―è –Ϋ–Α –¥–Β–≥―Ä–Α–¥–Α―Ü―•―é –≤ –Ω―Ä–Ψ―²–Β–Α―¹–Ψ–Φ―É , –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ –Ω―Ä–Β–Ζ–Β–Ϋ―²―É―é―²―¨―¹―è –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―• –Ζ –€–ù–Γ-I –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η. –Δ―É―² –Ω―Ä–Η –Ζ―É―¹―²―Ä―•―΅―• ―½―Ö ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―é―²―¨ CD8+ T-–Κ–Μ―•―²–Η–Ϋ–Η (–Δ-–Κ―•–Μ–Β―Ä–Η), ―è–Κ―• ―Ä–Β–Α–Μ―•–Ζ―É―é―²―¨ ―Ü–Η―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ―É ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨. –ï–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ―• –±―•–Μ–Κ–Η ―Ä–Ψ–Ζ―â–Β–Ω–Μ―é―é―²―¨―¹―è –Μ―•–Ζ–Ψ–Φ–Ϋ–Η–Φ–Η –Ω―Ä–Ψ―²–Β–Α–Ζ–Α–Φ–Η , –≤–Κ–Μ―é―΅–Α―é―²―¨―¹―è –≤ ―¹–Κ–Μ–Α–¥ MHC-II ―• ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―é―²―¨―¹―è ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η CD4+ –Δ-–Κ–Μ―•―²–Η–Ϋ (–Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤). –û―¹―²–Α–Ϋ–Ϋ―• –≤–Η–Κ–Μ–Η–Κ–Α―é―²―¨ ―è–Κ –Κ–Μ―•―²–Η–Ϋ–Ϋ―É, ―²–Α–Κ ―• –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨.
–®–Μ―è―Ö–Η –Ω―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥―É –Α–Ϋ―²–Η–≥–Β–Ϋ―É ―• ―³–Ψ―Ä–Φ–Η ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•
–¦–Ψ–Κ–Α–Μ―•–Ζ–Α―Ü―•―è –Α–Ϋ―²–Η–≥–Β–Ϋ―É
–û―¹–Ϋ–Ψ–≤–Ϋ–Η–Ι ―•–Ϋ―¹―²―Ä―É–Φ–Β–Ϋ―² –Ω―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥―É
–ê–Ϋ―²–Η–≥–Β–Ϋ-–Ω―Ä–Β–Ζ–Β–Ϋ―²―É―é―΅–Η–Ι –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹
–ö–Μ―•―²–Η–Ϋ–Η, ―â–Ψ ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―é―²―¨ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ –Α–Ϋ―²–Η–≥–Β–Ϋ-–€–ù–Γ
–Ü–Φ―É–Ϋ–Ϋ–Α –≤―•–¥–Ω–Ψ–≤―•–¥―¨
–£ –Κ–Μ―•―²–Η–Ϋ―•
–ü―Ä–Ψ―²–Β–Α―¹–Ψ–Φ–Α
–€–ù–Γ-I
–Δ-–Κ―•–Μ–Β―Ä–Η
–Π–Η―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ–Α
–ü–Ψ–Ζ–Α –Κ–Μ―•―²–Η–Ϋ–Ψ―é
–¦―•–Ζ–Ψ―¹–Ψ–Φ–Α
–€–ù–Γ-II
–Δ-―Ö–Β–Μ–Ω–Β―Ä–Η
–ö–Μ―•―²–Η–Ϋ–Ϋ–Α, –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Α
–Γ―Ö–Β–Φ–Α –Ω―Ä–Β–Ζ–Β–Ϋ―²–Α―Ü―•―½ –Α–Ϋ―²–Η–≥–Β–Ϋ―É –Ω–Ψ ―à–Μ―è―Ö―É –€–ù–Γ-I –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―è –Ω–Β―Ä–Β–¥–±–Α―΅–Α―î –Β–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ–Η–Ι ―¹–Η–Ϋ―²–Β–Ζ –Α–Ϋ―²–Η–≥–Β–Ϋ―É, ―²–Ψ–Φ―É ―Ü–Β–Ι ―à–Μ―è―Ö ―î –Ω–Β―Ä–Β–≤–Α–Ε–Α―é―΅–Η–Φ. –ü―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥ –Α–Ϋ―²–Η–≥–Β–Ϋ―É –Ω–Ψ ―à–Μ―è―Ö―É –€–ù–Γ-I –Ω―Ä–Ψ―Ö–Ψ–¥–Η―²―¨ –≤ –Κ―•–Μ―¨–Κ–Α –Β―²–Α–Ω―•–≤. –Γ–Η–Ϋ―²–Β–Ζ–Ψ–≤–Α–Ϋ–Η–Ι –≤ ―è–¥―Ä―• –±―•–Μ–Ψ–Κ ―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―²―É―î―²―¨―¹―è –≤ ―Ü–Η―²–Ψ–Ω–Μ–Α–Ζ–Φ―É, ―Ä–Ψ–Ζ―â–Β–Ω–Μ―é―î―²―¨―¹―è –Ω―Ä–Ψ―²–Β–Α―¹–Ψ–Φ–Ψ―é –Ϋ–Α –Κ–Ψ―Ä–Ψ―²–Κ―• –Ω–Β–Ω―²–Η–¥–Η βÄî –Β–Ω―•―²–Ψ–Ω–Η, ―è–Κ―• ―¹–Ω–Β―Ü―•–Α–Μ―¨–Ϋ–Η–Φ–Η –±―•–Μ–Κ–Α–Φ–Η-―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―²–Β―Ä–Α–Φ–Η –Α–Ϋ―²–Η–≥–Β–Ϋ―•–≤ (–Δ–ê–†, transporter associated with antigen processing) –Ω–Β―Ä–Β–Ϋ–Ψ―¹―è―²―¨―¹―è –≤ –Β–Ϋ–¥–Ψ–Ω–Μ–Α–Ζ–Φ–Α―²–Η―΅–Ϋ–Η–Ι ―Ä–Β―²–Η–Κ―É–Μ―É–Φ (–ï–ü–†). –£ –ï–ü–† –Κ–Ψ–Ε–Β–Ϋ –Β–Ω―•―²–Ψ–Ω ―¹–Ω–Ψ–Μ―É―΅–Α―î―²―¨―¹―è –Ζ –Φ–Ψ–Μ–Β–Κ―É–Μ–Ψ―é MHC-I, –Ω―•―¹–Μ―è ―΅–Ψ–≥–Ψ ―É―²–≤–Ψ―Ä–Β–Ϋ–Η–Ι –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―î―²―¨―¹―è –≤ –Α–Ω–Α―Ä–Α―² –™–Ψ–Μ―¨–¥–Ε―• (–ê–™) –Ϋ–Α –≥–Μ―•–Κ–Ψ–Ζ–Η–Μ―é–≤–Α–Ϋ–Ϋ―è . –½–≤―•–¥―²–Η –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ ―É ―¹–Κ–Μ–Α–¥―• –≤–Β–Ζ–Η–Κ―É–Μ–Η –Ω―Ä―è–Φ―É―î –¥–Ψ –Ω–Μ–Α–Ζ–Φ–Α―²–Η―΅–Ϋ–Ψ―½ –Φ–Β–Φ–±―Ä–Α–Ϋ–Η. –ü―•―¹–Μ―è –Ζ–Μ–Η―²―²―è –≤–Β–Ζ–Η–Κ―É–Μ–Η –Ζ –Ω–Μ–Α–Ζ–Φ–Α–Μ–Β–Φ–Ψ―é –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ –Ψ–Ω–Η–Ϋ―è―î―²―¨―¹―è –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ―• –Κ–Μ―•―²–Η–Ϋ–Η, –¥–Β ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―î―²―¨―¹―è ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η –Δ-–Κ―•–Μ–Β―Ä―•–≤, ―è–Κ―• –≤–Ψ–Μ–Ψ–¥―•―é―²―¨ ―Ü–Η―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ–Ψ―é –Α–Κ―²–Η–≤–Ϋ―•―¹―²―é[ 35]
–û―¹–Ϋ–Ψ–≤–Ϋ–Η–Φ –¥–Ε–Β―Ä–Β–Μ–Ψ–Φ –Ω–Β–Ω―²–Η–¥―•–≤, ―â–Ψ –Ζ–≤'―è–Ζ―É―é―²―¨―¹―è –Ζ –€–ù–Γ-II ―î –Β–Κ–Ζ–Ψ–≥–Β–Ϋ–Ϋ―• –±―•–Μ–Κ–Η, ―è–Κ―• –Ω–Ψ―²―Ä–Α–Ω–Η–Μ–Η –≤ –Κ–Μ―•―²–Η–Ϋ―É –Ζ –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é –Β–Ϋ–¥–Ψ―Ü–Η―²–Ψ–Ζ―É . –û–¥–Ϋ–Α–Κ –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ, ―â–Ψ –¥–Β―è–Κ―• –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Κ–Μ―•―²–Η–Ϋ–Ϋ―• –±―•–Μ–Κ–Η ―²–Α–Κ–Ψ–Ε –Φ–Ψ–Ε―É―²―¨ –±―É―²–Η –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Η–Φ–Η –≤ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―• –Ζ –€–ù–Γ-II[ 36] –Μ―•–Ζ–Ψ―¹–Ψ–Φ–Η , –¥–Β –Α–Ϋ―²–Η–≥–Β–Ϋ ―Ä–Ψ–Ζ―â–Β–Ω–Μ―é―î―²―¨―¹―è –Ω―•–¥ –¥―•―î―é –Κ–Η―¹–Μ–Η―Ö –Ω―Ä–Ψ―²–Β–Α–Ζ. –ü―•―¹–Μ―è ―Ü―¨–Ψ–≥–Ψ –Μ―•–Ζ–Ψ―¹–Ψ–Φ–Α, ―â–Ψ –Φ―•―¹―²–Η―²―¨ –Β–Ω―•―²–Ψ–Ω–Η, –Ζ–Μ–Η–≤–Α―î―²―¨―¹―è –Ζ –≤–Β–Ζ–Η–Κ―É–Μ–Ψ―é, ―è–Κ–Α –Ϋ–Β―¹–Β –Φ–Ψ–Μ–Β–Κ―É–Μ―É –€–ù–Γ-II. –£―¹–Β―Ä–Β–¥–Η–Ϋ―• –Ψ–±'―î–¥–Ϋ–Α–Ϋ–Ψ―½ –≤–Β–Ζ–Η–Κ―É–Μ–Η ―É―²–≤–Ψ―Ä―é―î―²―¨―¹―è –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ –Β–Ω―•―²–Ψ–Ω-–€–ù–Γ-II, ―è–Κ–Η–Ι –Ω―•―¹–Μ―è –Ζ–Μ–Η―²―²―è –≤–Β–Ζ–Η–Κ―É–Μ–Η –Ζ –Ω–Μ–Α–Ζ–Φ–Α–Μ–Β–Φ–Ψ―é –≤–Η–Ϋ–Ψ―¹–Η―²―¨―¹―è –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ―é –Κ–Μ―•―²–Η–Ϋ–Η. –Δ―É―² ―Ü–Β–Ι –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―î―²―¨―¹―è ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤, –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―• ―΅–Ψ–≥–Ψ –≤―•–¥–±―É–≤–Α―î―²―¨―¹―è ―½―Ö –Α–Κ―²–Η–≤–Α―Ü―•―è. –Π–Β –Ω―Ä–Η–Ζ–≤–Ψ–¥–Η―²―¨ –¥–Ψ ―¹―²–Η–Φ―É–Μ―è―Ü―•―½ ―è–Κ –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ–≥–Ψ (–Α–Κ―²–Η–≤–Α―Ü―•―è –Δ-–Κ―•–Μ–Β―Ä―•–≤), ―²–Α–Κ ―• –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―•–Φ―É–Ϋ―•―²–Β―²―É (–Α–Κ―²–Η–≤–Α―Ü―•―è –£-–Μ―•–Φ―³–Ψ―Ü–Η―²―•–≤ ).
–Δ―Ä–Α–¥–Η―Ü―•–Ι–Ϋ–Α –≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―è ―Ä–Ψ–Ζ―΅–Η–Ϋ–Ϋ–Η–Φ–Η –±―•–Μ–Κ–Ψ–≤–Η–Φ–Η –Α–Ϋ―²–Η–≥–Β–Ϋ–Α–Φ–Η –Ϋ–Α―Ü―•–Μ–Β–Ϋ–Α –Ϋ–Α –Φ–Ψ–±―•–Μ―•–Ζ–Α―Ü―•―é T-―Ö–Β–Μ–Ω–Β―Ä―•–≤. –ü–Ψ―Ä―•–≤–Ϋ―è–Ϋ–Ψ –Ϋ–Η–Ζ―¨–Κ–Α –≤―•–¥–Ω–Ψ–≤―•–¥―¨ –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤ ―î –Ψ–¥–Ϋ–Η–Φ –Ζ –Ϋ–Β–¥–Ψ–Μ―•–Κ―•–≤ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ. –Δ–Α–Κ–Ψ–Ε –Ϋ–Η–Ϋ―•―à–Ϋ―î –Ω–Ψ–Κ–Ψ–Μ―•–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –Ϋ–Β –Ζ–¥–Α―²–Ϋ–Β ―•–Ϋ–¥―É–Κ―É–≤–Α―²–Η –Ω―Ä–Ψ–¥―É–Κ―Ü―•―é –≤–Η―¹–Ψ–Κ–Η―Ö ―²–Η―²―Ä―•–≤ –Α–Ϋ―²–Η―²―•–Μ. –©–Ψ–±–Η –Ω―•–¥–≤–Η―â–Η―²–Η –Α–Κ―²–Η–≤–Α―Ü―•―é –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤, –Α–Ϋ―²–Η–≥–Β–Ϋ –Ω–Ψ―²―Ä―•–±–Ϋ–Ψ –Ω–Β―Ä–Β–Ϋ–Α–Ω―Ä–Α–≤–Η―²–Η –Ϋ–Α ―à–Μ―è―Ö –€–ù–Γ-II. –î–Μ―è ―Ü―¨–Ψ–≥–Ψ –≤ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ―É –≤–±―É–¥–Ψ–≤―É―é―²―¨ ―¹–Η–≥–Ϋ–Α–Μ –Μ―•–Ζ–Ψ―¹–Ψ–Φ–Ϋ–Ψ―½ –Μ–Ψ–Κ–Α–Μ―•–Ζ–Α―Ü―•―½: ―¹–Η–Ϋ―²–Β–Ζ–Ψ–≤–Α–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ –±―É–¥–Β –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―²–Η―¹―¨ –≤ –Μ―•–Ζ–Ψ―¹–Ψ–Φ–Η, –Α –Ζ–Ϋ–Α―΅–Η―²―¨ ―¹―²―É–Ω–Α―²–Η–Φ–Β –Ϋ–Α ―à–Μ―è―Ö –€–ù–Γ-II[ 35]
–™–Ψ–Μ–Ψ–≤–Ϋ–Β –Ω–Η―²–Α–Ϋ–Ϋ―è ―â–Ψ–¥–Ψ –Φ–Α–Ι–±―É―²–Ϋ―¨–Ψ–≥–Ψ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ ―¹―²–Ψ―¹―É―î―²―¨―¹―è –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è ―½―Ö –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―•. –ù–Α ―¹―¨–Ψ–≥–Ψ–¥–Ϋ―• –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨―¹―è –≤–Β–Μ–Η–Κ–Α –Κ―•–Μ―¨–Κ―•―¹―²―¨ –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ―¨, –Ω―Ä–Η―¹–≤―è―΅–Β–Ϋ–Η―Ö –Ψ–Ω―²–Η–Φ―•–Ζ–Α―Ü―•―½ ―Ä–Ψ–Ζ―Ä–Ψ–±–Μ–Β–Ϋ–Η―Ö –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ. –ü–Ψ―à―É–Κ ―Ä―•―à–Β–Ϋ–Ϋ―è –≤–Β–¥–Β―²―¨―¹―è –≤ –¥–≤–Ψ―Ö –Ϋ–Α–Ω―Ä―è–Φ–Α―Ö: –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –≤–Α–Κ―Ü–Η–Ϋ–Η ―²–Α –Ζ–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ–Ψ―¹―²―• –Ζ–Α–Κ–Ψ–¥–Ψ–≤–Α–Ϋ–Ψ–≥–Ψ –Α–Ϋ―²–Η–≥–Β–Ϋ―É.
–£–Α–Ε–Μ–Η–≤–Η–Φ –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–Φ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η ―î –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä . –ë–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ―• –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Η –Ϋ–Β –Ω―•–¥―Ö–Ψ–¥―è―²―¨ –¥–Μ―è –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –Α–Ϋ―²–Η–≥–Β–Ϋ–Ϋ―É –≤ –Κ–Μ―•―²–Η–Ϋ–Α―Ö ―¹―¹–Α–≤―Ü―•–≤ , ―²–Ψ–Φ―É –Ζ–Α–Φ―•―¹―²―¨ –Ϋ–Η―Ö –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É–≤–Α–Μ–Η –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Η –Ψ–Ϋ–Κ–Ψ–≥–Β–Ϋ–Ϋ–Η―Ö –≤―•―Ä―É―¹―•–≤. –½–Α―Ä–Α–Ζ –¥–Μ―è –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è –±–Β–Ζ–Ω–Β―΅–Ϋ–Ψ―¹―²―• –≤–Α–Κ―Ü–Η–Ϋ ―½―Ö –Ζ–Α–Φ―•–Ϋ–Η–Μ–Η –Ϋ–Α –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Η –≤―•–¥ –Ϋ–Β–Κ–Α–Ϋ―Ü–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ–Η―Ö –Ψ–±'―î–Κ―²―•–≤, –Ϋ–Α–Ω―Ä–Η–Κ–Μ–Α–¥, –Μ―é–¥―¹―¨–Κ–Ψ–≥–Ψ ―Ü–Η―²–Ψ–Φ–Β–≥–Α–Μ–Ψ–≤―•―Ä―É―¹―É (CMV). –î–Μ―è –±―•–Μ―¨―à–Ψ―¹―²―• –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ ―Ü–Β–Ι –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä ―î –Ψ–Ω―²–Η–Φ–Α–Μ―¨–Ϋ–Η–Φ –≤–Η–±–Ψ―Ä–Ψ–Φ: –≤―•–Ϋ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―î―²―¨―¹―è –≤–Η―¹–Ψ–Κ–Ψ―é –Β–Κ―¹–Ω―Ä–Β―¹―•―î―é –≤ ―à–Η―Ä–Ψ–Κ–Ψ–Φ―É –¥―•–Α–Ω–Α–Ζ–Ψ–Ϋ―• –Κ–Μ―•―²–Η–Ϋ. –î–Μ―è –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –≥–Β–Ϋ–Α –≤ –Κ–Ψ–Ϋ–Κ―Ä–Β―²–Ϋ–Η―Ö ―²–Κ–Α–Ϋ–Η–Ϋ–Α―Ö, –Ω–Β―Ä―¹–Ω–Β–Κ―²–Η–≤–Ϋ–Η–Φ ―î –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä―•–≤, ―¹–Ω–Β―Ü–Η―³―•―΅–Ϋ–Η―Ö –¥–Μ―è ―Ü―¨–Ψ–≥–Ψ ―²–Η–Ω―É ―²–Κ–Α–Ϋ–Η–Ϋ. –ù–Α–Ω―Ä–Η–Κ–Μ–Α–¥, –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Α –Φ'―è–Ζ–Ψ–≤–Ψ―½ –Κ―Ä–Β–Α―²–Η–Ϋ–Κ―•–Ϋ–Α–Ζ–Η –Ω―Ä–Η –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤–Ψ–Φ―É –≤–≤–Β–¥–Β–Ϋ―• –Ω―Ä–Η–Ζ–≤–Ψ–¥–Η―²―¨ –¥–Ψ –¥–Β―¹―è―²–Η–Κ―Ä–Α―²–Ϋ–Ψ–≥–Ψ –Ζ–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è ―¹–Η–Ϋ―²–Β–Ζ―É –Α–Ϋ―²–Η―²―•–Μ –Ι ―•–Ϋ–¥―É–Κ―Ü―•―½ –Δ-–Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•, ―΅–Η–Φ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è –Α–Ϋ–Α–Μ–Ψ–≥―•―΅–Ϋ–Ψ―½ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –Ζ CMV –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Ψ–Φ. –Δ–Α–Κ–Ψ–Ε –≤–Η―¹–Ψ–Κ―É –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ ―É –Φ―•–Ψ―Ü–Η―²–Α―Ö –Ω–Ψ–Κ–Α–Ζ–Α–≤ –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä –≥–Β–Ϋ―É –¥–Β―¹–Φ―•–Ϋ―É, ―â–Ψ –Κ–Ψ–¥―É―î –Ψ–¥–Η–Ϋ ―•–Ζ –±―•–Μ–Κ―•–≤ ―Ü–Η―²–Ψ―¹–Κ–Β–Μ–Β―²―É . –î–Μ―è –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η –≤ –Κ–Β―Ä–Α―²–Η–Ϋ–Ψ―Ü–Η―²–Α―Ö (–Κ–Μ―•―²–Η–Ϋ–Η –Β–Ω―•―²–Β–Μ―•–Α–Μ―¨–Ϋ–Ψ―½ ―²–Κ–Α–Ϋ–Η–Ϋ–Η) –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―é―²―¨ –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Η –≥–Β–Ϋ―É –Φ–Β―²–Α–Μ–Ψ―²―•–Ψ–Ϋ–Β―½–Ϋ―É (–±―•–Μ–Ψ–Κ, ―â–Ψ –Ζ–≤'―è–Ζ―É―î –≤–Α–Ε–Κ―• –Φ–Β―²–Α–Μ–Η) –Α–±–Ψ –≥–Β–Ϋ―É –≥―•–¥―Ä–Ψ–Κ―¹–Η–Μ–Α–Ζ–Η –≤―•―²–Α–Φ―•–Ϋ―É D3 [ 37] [ 13]
–†―•–≤–Β–Ϋ―¨ ―•–Ϋ―•―Ü―•–Α―Ü―•―½ ―²―Ä–Α–Ϋ―¹–Κ―Ä–Η–Ω―Ü―•―½, ―è–Κ –Ω―Ä–Α–≤–Η–Μ–Ψ, –Ω―•–¥–≤–Η―â―É―î―²―¨―¹―è –Ζ–Α ―Ä–Α―Ö―É–Ϋ–Ψ–Κ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Α–Ϋ–Ϋ―è ―¹–Η–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–Φ–Ψ―²–Ψ―Ä–Α ―²–Α –Β–Ϋ―Ö–Α–Ϋ―¹–Β―Ä―•–≤ , –Α –Ψ―¹–Ψ–±–Μ–Η–≤–Ψ―¹―²―• ―²–Β―Ä–Φ―•–Ϋ–Α―Ü―•―½ –Φ–Ψ–Ε―É―²―¨ ―¹―²–Α―²–Η –Ψ–±–Φ–Β–Ε―É―é―΅–Η–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–Φ. –ï―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –Ω–Ψ–Μ―•–Α–¥–Β–Ϋ―•–Μ―é–≤–Α–Ϋ–Ϋ―è ―• –Ω―Ä–Ψ―Ü–Β―¹–Η–Ϋ–≥―É –Ω–Β―Ä–≤–Η–Ϋ–Ϋ–Ψ–≥–Ψ –†–ù–ö-―²―Ä–Α–Ϋ―¹–Κ―Ä–Η–Ω―²―É –Ζ–Φ―•–Ϋ―é―î―²―¨―¹―è –Ζ–Α–Μ–Β–Ε–Ϋ–Ψ –≤―•–¥ –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ–Ψ―¹―²―• polyA-―¹–Η–≥–Ϋ–Α–Μ―É . –Δ–Ψ–±―²–Ψ, –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―¨ –Ω–Ψ–Μ―•–Α–¥–Β–Ϋ―•–Μ―É–≤–Α–Ϋ–Ϋ―è –≤–Ω–Μ–Η–≤–Α―î –Ϋ–Α ―¹–Η–Ϋ―²–Β–Ζ –Α–Ϋ―²–Η–≥–Β–Ϋ―É. –ù–Α–Ω―Ä–Η–Κ–Μ–Α–¥, ―à–Η―Ä–Ψ–Κ–Ψ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É–≤–Α–Ϋ–Η–Ι polyA-―¹–Η–≥–Ϋ–Α–Μ –≤―•―Ä―É―¹―É SV40 –Φ–Α―î –Φ–Β–Ϋ―à―É –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ ―΅–Η–Φ ―¹–Η–≥–Ϋ–Α–Μ –Ω–Ψ–Μ―•–Α–¥–Β–Ϋ―•–Μ―é–≤–Α–Ϋ–Ϋ―è –≥–Β–Ϋ―É Έ≤-–≥–Μ–Ψ–±―•–Ϋ―É –Κ―Ä–Ψ–Μ–Η–Κ–Α –Α–±–Ψ –≥–Β–Ϋ―É –≥–Ψ―Ä–Φ–Ψ–Ϋ―É ―Ä–Ψ―¹―²―É –±–Η–Κ–Α[ 13]
–î–Μ―è –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ―½ ―²―Ä–Α–Ϋ―¹–Μ―è―Ü―•―½ –Φ–†–ù–ö ―¹―¹–Α–≤―Ü―•–≤ –Ω–Ψ–≤–Η–Ϋ–Ϋ–Α ―²–Α–Κ –Ζ–≤–Α–Ϋ―É –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―¨ –ö–Ψ–Ζ–Α–Κ . –£―¹―²–Α–≤–Κ–Α ―Ü―•―î―½ –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ–Ψ―¹―²―• –≤ –î–ù–ö-–Κ–Ψ–Ϋ―¹―²―Ä―É–Κ―Ü―•―é –Φ–Ψ–Ε–Β ―¹―É―²―²―î–≤–Ψ –Ζ–±―•–Μ―¨―à―É–≤–Α―²–Η ―Ä―•–≤–Β–Ϋ―¨ ―¹–Η–Ϋ―²–Β–Ζ―É –Α–Ϋ―²–Η–≥–Β–Ϋ―É. –©–Ψ–± –†–ù–ö-–Ω–Ψ–Μ―•–Φ–Β―Ä–Α–Ζ–Α –Ϋ–Β –Ω―Ä–Ψ―¹–Κ–Ψ―΅–Η–Μ–Α ―¹―²–Ψ–Ω-–Κ–Ψ–¥–Ψ–Ϋ –≥–Β–Ϋ―É ―• –Ϋ–Β –≤―•–¥–±―É–≤―¹―è ―¹–Η–Ϋ―²–Β–Ζ –Ω–Ψ–¥–Ψ–≤–Ε–Β–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―²–Β―½–Ϋ―É, ―è–Κ–Η–Ι –Ϋ–Β –Ζ–Φ–Ψ–Ε–Β –Ω–Ψ―²―•–Φ –Ϋ–Α–±―É―²–Η –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ―½ ―É–Κ–Μ–Α–¥–Κ–Η, –≥–Β–Ϋ –Φ–Ψ–Ε–Ϋ–Α –Ζ–Α–Κ―•–Ϋ―΅―É–≤–Α―²–Η –Ω–Ψ–¥–≤―•–Ι–Ϋ–Η–Φ ―¹―²–Ψ–Ω-–Κ–Ψ–¥–Ψ–Ϋ–Ψ–Φ [ 37]
–ü―Ä–Η –Κ–Ψ–Ϋ―¹―²―Ä―É―é–≤–Α–Ϋ–Ϋ―• –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η ―²–Α–Κ–Ψ–Ε –Ϋ–Α–Φ–Α–≥–Α―é―²―¨―¹―è –Ψ–Ω―²–Η–Φ―•–Ζ―É–≤–Α―²–Η ―½―½ –Κ–Ψ–¥–Ψ–Ϋ–Η . –ü―Ä–Ψ―Ü–Β–¥―É―Ä–Α –Ψ–Ω―²–Η–Φ―•–Ζ–Α―Ü―•―½ –Ψ–Ζ–Ϋ–Α―΅–Α―î –Ζ–Α–Φ―•–Ϋ―É –Κ–Ψ–¥–Ψ–Ϋ―•–≤ –≤ –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ–Ψ―¹―²―• –≥–Β–Ϋ–Α ―²–Α–Κ–Η–Φ ―΅–Η–Ϋ–Ψ–Φ, ―â–Ψ–± –Α–Φ―•–Ϋ–Ψ–Κ–Η―¹–Μ–Ψ―²–Ϋ–Α –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―¨ –±―•–Μ–Κ–Α –Ϋ–Β –Ζ–Φ―•–Ϋ―é–≤–Α–Μ–Α―¹―¨, –Α–Μ–Β –Ζ–±―•–Μ―¨―à―É–≤–Α–Μ–Α―¹―¨ –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ ―²―Ä–Α–Ϋ―¹–Μ―è―Ü―•―½ –Ι–Ψ–≥–Ψ –Φ–†–ù–ö. –ü―Ä–Η―΅–Η–Ϋ–Ψ―é ―î ―²–Β, ―â–Ψ –±―•–Μ―¨―à―•―¹―²―¨ –Α–Φ―•–Ϋ–Ψ–Κ–Η―¹–Μ–Ψ―² –Κ–Ψ–¥―É―é―²―¨―¹―è –±―•–Μ―¨―à ―΅–Η–Φ –Ψ–¥–Ϋ–Η–Φ –Κ–Ψ–¥–Ψ–Ϋ–Ψ–Φ. –ö–Ψ–Ε–Β–Ϋ –Κ–Ψ–¥–Ψ–Ϋ –Φ–Α―î ―¹–≤–Ψ―é ―²–†–ù–ö ―• –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―•―¹―²―¨ ―Ä―•–Ζ–Ϋ–Η―Ö ―²–†–ù–ö –≤ –Κ–Μ―•―²–Η–Ϋ―• –Ϋ–Β–Ψ–¥–Ϋ–Α–Κ–Ψ–≤–Α, –Ω―Ä–Η―΅–Ψ–Φ―É –≤–Ψ–Ϋ–Α ―²–Α–Κ–Ψ–Ε –≤–Α―Ä―•―é―î –Ζ–Α–Μ–Β–Ε–Ϋ–Ψ –≤―•–¥ –≤–Η–¥―É –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ―É. –ö–Ψ–¥–Ψ–Ϋ–Η –Ω―•–¥–±–Η―Ä–Α―é―²―¨ ―²–Α–Κ–Η–Φ ―΅–Η–Ϋ–Ψ–Φ, ―â–Ψ–± –Ϋ–Α―è–≤–Ϋ―•―¹―²―¨ –Ω–Ψ―²―Ä―•–±–Ϋ–Ψ―½ ―²–†–ù–ö –Ω―Ä–Η ―¹–Η–Ϋ―²–Β–Ζ―• –Α–Ϋ―²–Η–≥–Β–Ϋ―É –Ϋ–Β ―¹―²–Α–Μ–Α –Μ―•–Φ―•―²―É―é―΅–Η–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–Φ[ 13] [ 38]
–Ξ–Ψ―΅–Α ―¹–Η–Μ–Α ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –Κ–Ψ―Ä–Β–Μ―é―î –Ζ ―Ä―•–≤–Ϋ–Β–Φ –Β–Κ―¹–Ω―Ä–Β―¹―•―½ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Η, –Ω―Ä–Ψ―²–Β –¥–Μ―è –Κ–Ψ–Ε–Ϋ–Ψ–≥–Ψ –Α–Ϋ―²–Η–≥–Β–Ϋ―É ―•―¹–Ϋ―É―î –Ω–Β–≤–Ϋ–Β –Ω–Μ–Α―²–Ψ, –Ω―•―¹–Μ―è ―è–Κ–Ψ–≥–Ψ –Ζ–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è –Κ―•–Μ―¨–Κ–Ψ―¹―²―• –Α–Ϋ―²–Η–≥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―²–Β―½–Ϋ―É –Ϋ–Β –Ω―•–¥–≤–Η―â―É–≤–Α―²–Η–Φ–Β –Ω―Ä–Ψ–¥―É–Κ―Ü―•―é –Α–Ϋ―²–Η―²―•–Μ. –£–Ψ–¥–Ϋ–Ψ―΅–Α―¹, –¥–Ψ―¹―è–≥―²–Η –±―•–Μ―¨―à ―¹–Η–Μ―¨–Ϋ–Ψ―½ ―•–Φ―É–Ϋ–Ϋ–Ψ―½ ―Ä–Β–Α–Κ―Ü―•―½ –Φ–Ψ–Ε–Ϋ–Α –Ζ–Α ―Ä–Α―Ö―É–Ϋ–Ψ–Κ –Ψ–Ω―²–Η–Φ―•–Ζ–Α―Ü―•―½ –Α–Ϋ―²–Η–≥–Β–Ϋ―É[ 39] –Ψ–±'―î–¥–Ϋ–Α–Ϋ–Ϋ―è –Α–Ϋ―²–Η–≥–Β–Ϋ―É –Ζ –Μ―•–≥–Α–Ϋ–¥–Ψ–Φ –¥–Ψ –Ω–Β–≤–Ϋ–Ψ–≥–Ψ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α –Α–Ϋ―²–Η–≥–Β–Ϋ-–Ω―Ä–Β–Ζ–Β–Ϋ―²―É―é―΅–Ψ―½ –Κ–Μ―•―²–Η–Ϋ–Η . –Δ–Α–Κ–Η–Φ –Μ―•–≥–Α–Ϋ–¥–Ψ–Φ –Φ–Ψ–Ε–Β –±―É―²–Η –Φ–Α―Ä–Κ–Β―Ä–Ϋ–Η–Ι –±―•–Μ–Ψ–Κ CD40, –Ω–Ψ–Ζ–Α–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι –¥–Ψ–Φ–Β–Ϋ Fms-–Ω–Ψ–¥―•–±–Ϋ–Ψ―½ ―²–Η―Ä–Ψ–Ζ–Η–Ϋ–Κ―•–Ϋ–Α–Ζ–Η-3 –Α–±–Ψ –Α–Ϋ―²–Η–≥–Β–Ϋ-4 –Δ-–Κ―•–Μ–Β―Ä―•–≤[ 40]
–ü–Ψ–Μ–Β–≥―à–Β–Ϋ–Ϋ―è –¥–Β–≥―Ä–Α–¥–Α―Ü―•―½ –Α–Ϋ―²–Η–≥–Β–Ϋ―É –≤ –Ω―Ä–Ψ―²–Β–Α―¹–Ψ–Φ―• ―΅–Η –Μ―•–Ζ–Ψ―¹–Ψ–Φ―• ―²–Α–Κ–Ψ–Ε ―¹―²–Η–Φ―É–Μ―é–≤–Α―²–Η–Φ–Β ―•–Φ―É–Ϋ–Ϋ―É ―Ä–Β–Α–Κ―Ü―•―é. –î–Μ―è –Ω―•–¥―¹–Η–Μ–Β–Ϋ–Ϋ―è –Ω―Ä–Ψ―²–Β–Μ―•–Ψ―²–Η―΅–Ϋ–Ψ–≥–Ψ ―Ä–Ψ–Ζ―â–Β–Ω–Μ–Β–Ϋ–Ϋ―è –Α–Ϋ―²–Η–≥–Β–Ϋ―É, –≤ –Ι–Ψ–≥–Ψ –Ω–Ψ―¹–Μ―•–¥–Ψ–≤–Ϋ―•―¹―²―¨ –≤–±―É–¥–Ψ–≤―É―é―²―¨ ―¹–Η–≥–Ϋ–Α–Μ ―É–±―•–Κ–≤―•―²–Η–Ϋ―É–≤–Α–Ϋ–Ϋ―è [ 35] –Κ―•–Μ―¨–Κ–Α –Β–Ω―•―²–Ψ–Ω―•–≤ ―Ä―•–Ζ–Ϋ–Ψ–≥–Ψ –Ω–Ψ―Ö–Ψ–¥–Ε–Β–Ϋ–Ϋ―è , –¥–Ψ–Ζ–≤–Ψ–Μ―è―î –Ζ–Ϋ–Α―΅–Ϋ–Ψ ―Ä–Ψ–Ζ―à–Η―Ä–Η―²–Η ―¹–Ω–Β–Κ―²―Ä ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•[ 39]
–î–Μ―è –Ω―Ä–Ψ―²–Η–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η―Ö –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ―é ―î –Κ–Ψ–Φ–±―•–Ϋ–Α―Ü―•―è ¬Ϊ–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ + –≤―•―Ä―É―¹–Ϋ–Η–Ι –Α–±–Ψ –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ¬Μ . –ù–Α–Ω―Ä–Η–Κ–Μ–Α–¥, –Ω–Ψ―î–¥–Ϋ–Α–Ϋ–Ϋ―è –Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Ψ–≥–Ψ –Α–Ϋ―²–Η–≥–Β–Ϋ―É –Ζ –Β–Ω―•―²–Ψ–Ω–Ψ–Φ ―²–Ψ–Κ―¹–Η–Ϋ―É –Ω―Ä–Α–≤―Ü―é –Ζ–Ϋ–Α―΅–Ϋ–Ψ –Ω―•–¥–≤–Η―â―É―î –Α–Κ―²–Η–≤–Α―Ü―•―é –Δ-–Κ―•–Μ–Β―Ä―•–≤ –Ω―Ä–Ψ―²–Η ―Ä–Α–Κ–Ψ–≤–Η―Ö –Κ–Μ―•―²–Η–Ϋ[ 15] [ 41]
–ü―Ä–Η –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―• ―²―Ä–Α–¥–Η―Ü―•–Ι–Ϋ–Η―Ö –≤–Α–Κ―Ü–Η–Ϋ –¥–Μ―è –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –¥–Ψ –Ϋ–Η―Ö –¥–Ψ–¥–Α―é―²―¨ –Α–¥'―é–≤–Α–Ϋ―²–Η. –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α –Φ–Α―î –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ–Β –Ω–Ψ―Ö–Ψ–¥–Ε–Β–Ϋ–Ϋ―è, ―²–Ψ–Φ―É –≤–Ψ–Ϋ–Α ―¹–Α–Φ–Α ―î ―•–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―è―²–Ψ―Ä–Ψ–Φ . –î–Μ―è –Ω–Ψ―¹–Η–Μ–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –≤ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ―É –≤–±―É–¥–Ψ–≤―É―é―²―¨ –≥–Β–Ϋ–Η –Α–¥'―é–≤–Α–Ϋ―²―É –Α–±–Ψ –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É―é―²―¨ –¥–Ψ–¥–Α―²–Κ–Ψ–≤―É –Ω–Μ–Α–Ζ–Φ―•–¥―É, ―è–Κ–Α –Κ–Ψ–¥―É―î ―•–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―é―é―΅―• –±―•–Μ–Κ–Η[ 42]
–Λ―É–Ϋ–Κ―Ü―•―è –Ω–Μ–Α–Ζ–Φ―•–¥–Η –Ϋ–Β –Ψ–±–Φ–Β–Ε―É―î―²―¨―¹―è –¥–Ψ―¹―²–Α–≤–Κ–Ψ―é –≥–Β–Ϋ―•–≤ –≤ –Κ–Μ―•―²–Η–Ϋ–Η. –©–Β –≤ 1893 ―Ä–Ψ―Ü―• –±―É–Μ–Ψ –≤–Η―è–≤–Μ–Β–Ϋ–Ψ, ―â–Ψ ―¹―É–Φ―•―à –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ–Η―Ö –Μ―•–Ζ–Α―²―•–≤ –Ζ–Φ–Β–Ϋ―à―É―î –Ω―Ä–Ψ–≥―Ä–Β―¹―É–≤–Α–Ϋ–Ϋ―è ―Ä–Α–Κ–Ψ–≤–Η―Ö –Ω―É―Ö–Μ–Η–Ϋ, –Ω―Ä–Ψ―²–Β –Μ–Η―à–Β –≤ 1983 –≤―¹―²–Α–Ϋ–Ψ–≤–Η–Μ–Η, ―â–Ψ ―•–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―é―é―΅―• –≤–Μ–Α―¹―²–Η–≤–Ψ―¹―²―• –Μ―•–Ζ–Α―²―É –Ζ―É–Φ–Ψ–≤–Μ–Β–Ϋ―• –Φ–Ψ–Μ–Β–Κ―É–Μ–Α–Φ–Η –î–ù–ö –±–Α–Κ―²–Β―Ä―•―½[ 43] [ 44] Toll-–Ω–Ψ–¥―•–±–Ϋ–Η–Φ–Η ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η , ―è–Κ–Η―Ö –Ζ–Α–Μ–Β–Ε–Ϋ–Ψ –≤―•–¥ ―²–Η–Ω―É –Μ―•–≥–Α–Ϋ–¥–Α, –Ω–Ψ–¥―•–Μ―è―é―²―¨ –Ϋ–Α –Κ―•–Μ―¨–Κ–Α ―²–Η–Ω―•–≤. –ù–Β–Φ–Β―²–Η–Μ–Ψ–≤–Α–Ϋ―• CpG-–Φ–Ψ―²–Η–≤–Η ―Ä–Ψ–Ζ–Ω―•–Ζ–Ϋ–Α―î ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä TLR-9, ―Ä–Ψ–Ζ―²–Α―à–Ψ–≤–Α–Ϋ–Η–Ι –Ϋ–Α –Φ–Β–Φ–±―Ä–Α–Ϋ–Α―Ö –Β–Ϋ–¥–Ψ–Ω–Μ–Α–Ζ–Φ–Α―²–Η―΅–Ϋ–Ψ–≥–Ψ ―Ä–Β―²–Η–Κ―É–Μ―É–Φ―É –£-–Μ―•–Φ―³–Ψ―Ü–Η―²―•–≤, –¥–Β–Ϋ–¥―Ä–Η―²–Ϋ–Η―Ö –Κ–Μ―•―²–Η–Ϋ ―• –Ϋ–Α―²―É―Ä–Α–Μ―¨–Ϋ–Η―Ö –Κ―•–Μ–Β―Ä―•–≤. –½–≤'―è–Ζ―É–≤–Α–Ϋ–Ϋ―è ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α –Ζ –Ϋ–Β–Φ–Β―²–Η–Μ–Ψ–≤–Α–Ϋ–Η–Φ–Η CpG-–Φ–Ψ―²–Η–≤–Α–Φ–Η –Ζ–Α–Ω―É―¹–Κ–Α―î –Κ–Α―¹–Κ–Α–¥ ―Ä–Β–Α–Κ―Ü―•–Ι, –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―• ―è–Κ–Ψ–≥–Ψ ―•–Ϋ–¥―É–Κ―É―î―²―¨―¹―è ―¹–Η–Ϋ―²–Β–Ζ –Ω―Ä–Ψ–Ζ–Α–Ω–Α–Μ―¨–Ϋ–Η―Ö ―Ü–Η―²–Ψ–Κ―•–Ϋ―•–≤ βÄî ―•–Ϋ―²–Β―Ä―³–Β―Ä–Ψ–Ϋ―É-1 ―• IL-12[ 45]
–î–Μ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ ―è–Κ –Α–¥'―é–≤–Α–Ϋ―²–Η –Ϋ–Α–Ι―΅–Α―¹―²―•―à–Β –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É―é―²―¨ –≥–Β–Ϋ–Η ―Ü–Η―²–Ψ–Κ―•–Ϋ―•–≤ . –Π–Η―²–Ψ–Κ―•–Ϋ–Η βÄî ―Ü–Β –Κ–Μ–Α―¹ –±―•–Μ–Κ–Ψ–≤–Η―Ö –Φ–Ψ–Μ–Β–Κ―É–Μ, ―â–Ψ ―Ä–Β–≥―É–Μ―é―é―²―¨ –Φ―•–Ε–Κ–Μ―•―²–Η–Ϋ–Ϋ―• ―• –Φ―•–Ε―¹–Η―¹―²–Β–Φ–Ϋ―• –≤–Ζ–Α―î–Φ–Ψ–¥―•―½ –≤ –Ψ―Ä–≥–Α–Ϋ―•–Ζ–Φ―•, –Ζ–Ψ–Κ―Ä–Β–Φ–Α, ―³―É–Ϋ–Κ―Ü―•–Ψ–Ϋ―É–≤–Α–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ϋ–Ψ―½ ―¹–Η―¹―²–Β–Φ–Η. –£―¹―• ―Ü–Η―²–Ψ–Κ―•–Ϋ–Η, –Α ―½―Ö –≤―•–¥–Ψ–Φ–Ψ –Ω–Ψ–Ϋ–Α–¥ 30, –Φ–Ψ–Ε―É―²―¨ –Φ–Ψ–¥―É–Μ―é–≤–Α―²–Η ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨. –Π–Η―²–Ψ–Κ―•–Ϋ–Η IL2, IL-12, ―•–Ϋ―²–Β―Ä―³–Β―Ä–Ψ–Ϋ Έ≥, IL-15, IL-18 ―• IL-23 –Φ–Α―é―²―¨ ―¹―²–Η–Φ―É–Μ―é―é―΅–Η–Ι –≤–Ω–Μ–Η–≤ –Ϋ–Α –Δ-―Ö–Β–Μ–Ω–Β―Ä–Η –Ω–Β―Ä―à–Ψ–≥–Ψ –Κ–Μ–Α―¹―É. –î–Ψ ―Ü–Η―²–Ψ–Κ―•–Ϋ―•–≤, ―â–Ψ –Φ–Ψ–¥―É–Μ―é―é―²―¨ –¥―•―é –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤ –¥―Ä―É–≥–Ψ–≥–Ψ –Κ–Μ–Α―¹―É, –≤―•–¥–Ϋ–Ψ―¹―è―²―¨―¹―è: IL-4, IL-5, IL-6, IL-10 I IL-13. –Δ–Η–Ω ―Ü–Η―²–Ψ–Κ―•–Ϋ―É –Ω―•–¥–±–Η―Ä–Α―é―²―¨ –Ζ–≥―•–¥–Ϋ–Ψ ―²–Ψ–≥–Ψ, ―è–Κ–Η–Ι ―²–Η–Ω ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• ―Ö–Ψ―΅―É―²―¨ –Ω–Ψ―¹–Η–Μ–Η―²–Η[ 46]
–£―•–¥–Φ―•–Ϋ–Ϋ–Ψ―¹―²―• ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤ 1 ―• 2 –Κ–Μ–Α―¹―É
–£―•–¥–Φ―•–Ϋ–Ϋ–Ψ―¹―²―•
–Δ-―Ö–Β–Μ–Ω–Β―Ä–Η 1
–Δ-―Ö–Β–Μ–Ω–Β―Ä–Η 2
–™–Ψ–Μ–Ψ–≤–Ϋ–Α –Κ–Μ―•―²–Η–Ϋ–Α-–Ω–Α―Ä―²–Ϋ–Β―Ä
–€–Α–Κ―Ä–Ψ―³–Α–≥
–£-–Κ–Μ―•―²–Η–Ϋ–Α
–Ü–Φ―É–Ϋ–Ϋ–Α –≤―•–¥–Ω–Ψ–≤―•–¥―¨
–ö–Μ―•―²–Η–Ϋ–Ϋ–Α . –ü―•–¥―¹–Η–Μ―é―î –¥―•―é –Φ–Α–Κ―Ä–Ψ―³–Α–≥―•–≤.
–™―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Α .
–Γ―²–Η–Φ―É–Μ―é―î –Ω―Ä–Ψ–Μ―•―³–Β―Ä–Α―Ü―•―é –£-–Κ–Μ―•―²–Η–Ϋ.
–î–Ψ―¹―è–≥―²–Η –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –Φ–Ψ–Ε–Ϋ–Α –Ζ –¥–Ψ–Ω–Ψ–Φ–Ψ–≥–Ψ―é ―Ö–Β–Φ–Ψ–Κ―•–Ϋ―•–≤. –Ξ–Β–Φ–Ψ–Κ―•–Ϋ–Η βÄî ―Ü–Β ―¹―•–Φ–Β–Ι―¹―²–≤–Ψ ―Ü–Η―²–Ψ–Κ―•–Ϋ―•–≤, ―è–Κ―• –Ζ–¥–Α―²–Ϋ―• –≤–Η–Κ–Μ–Η–Κ–Α―²–Η ―Ö–Β–Φ–Ψ―²–Α–Κ―¹–Η―¹ ―΅―É―²–Μ–Η–≤–Η―Ö –¥–Ψ –Ϋ–Η―Ö –Κ–Μ―•―²–Η–Ϋ, –≤ ―²–Ψ–Φ―É ―΅–Η―¹–Μ―• –Ι ―•–Φ―É–Ϋ–Ϋ–Η―Ö. –½–Ψ–Κ―Ä–Β–Φ–Α, ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Η –¥–Ψ ―Ö–Β–Φ–Ψ–Κ―•–Ϋ―•–≤ ―î –Ϋ–Α –Α–Ϋ―²–Η–≥–Β–Ϋ–Ω–Β―Ä–Β–Ζ–Β–Ϋ―²―É―é―΅–Η―Ö –Κ–Μ―•―²–Η–Ϋ–Α―Ö ―Ö–Β–Φ–Ψ–Κ―•–Ϋ―•–≤. –½–≤'―è–Ζ―É–≤–Α–Ϋ–Ϋ―è ―Ö–Β–Φ–Ψ–Κ―•–Ϋ―É –Ζ―• ―¹–≤–Ψ―½–Φ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–Φ –Ω―Ä–Η–Ζ–≤–Ψ–¥–Η―²―¨ –¥–Ψ –Β–Ϋ–¥–Ψ―Ü–Η―²–Ψ–Ζ―É –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹―É –Α–Ϋ―²–Η–≥–Β–Ϋ-―Ö–Β–Φ–Ψ–Κ―•–Ϋ –≤―¹–Β―Ä–Β–¥–Η–Ϋ―É –ê–ü–ö. –Π―è ―¹―²―Ä–Α―²–Β–≥―•―è –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ –≤–Η–Κ–Ψ―Ä–Η―¹―²–Ψ–≤―É―î―²―¨―¹―è ―è–Κ –Ω―Ä–Η ―Ä–Ψ–Ζ―Ä–Ψ–±―Ü―• –Ω―Ä–Ψ―²–Η–≤―•―Ä―É―¹–Ϋ–Η―Ö –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ[ 47] [ 48]
–Λ―É–Ϋ–Κ―Ü―•―é –Α–¥'―é–≤–Α–Ϋ―²–Α ―²–Α–Κ–Ψ–Ε –Φ–Ψ–Ε–Β –≤–Η–Κ–Ψ–Ϋ―É–≤–Α―²–Η –±―•–Μ–Ψ–Κ HSP70 (heat-shock proteins, –±―•–Μ–Κ–Η ―²–Β–Ω–Μ–Ψ–≤–Ψ–≥–Ψ ―à–Ψ–Κ―É ). –Ü–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―é―é―΅–Α –¥―•―è HSP70 –±–Α–Ζ―É―î―²―¨―¹―è –Ϋ–Α –Ι–Ψ–≥–Ψ –Ζ–¥–Α―²–Ϋ–Ψ―¹―²―• –≤–Η―Ö–Ψ–¥–Η―²–Η –≤ –Ω–Ψ–Ζ–Α–Κ–Μ―•―²–Η–Ϋ–Ϋ–Η–Ι –Ω―Ä–Ψ―¹―²―•―Ä ―• –Ζ–≤'―è–Ζ―É–≤–Α―²–Η―¹―¨ –Ζ ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η –ê–ü–ö. –€–Β―Ö–Α–Ϋ―•–Ζ–Φ ―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―²―É HSP70 –Ϋ–Α–Ζ–Ψ–≤–Ϋ―• –Ω–Ψ–Κ–Η –Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –Ϋ–Β –Ζ'―è―¹–Ψ–≤–Α–Ϋ–Η–Ι, –Α–Μ–Β ―à–≤–Η–¥―à–Β –Ζ–Α –≤―¹–Β ―•―¹–Ϋ―É―î –Κ―•–Μ―¨–Κ–Α ―à–Μ―è―Ö―•–≤ βÄî –Β–Κ–Ζ–Ψ―Ü–Η―²–Ψ–Ζ, ―¹–Β–Κ―Ä–Β―Ü―•―è –Ϋ–Α–Ζ–Ψ–≤–Ϋ―• –Α–±–Ψ –≤–Η―Ö―•–¥ ―΅–Β―Ä–Β–Ζ –Κ–Α–Ϋ–Α–Μ[ 49] [ 50]
–€–Β―²–Ψ–¥ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α―Ü―•―½ –≤–Ψ–Μ–Ψ–¥―•―î –Ϋ–Η–Ζ–Κ–Ψ―é –Ω–Β―Ä–Β–≤–Α–≥, –Ϋ–Α–Ι–±―•–Μ―¨―à –≤–Α–Ε–Μ–Η–≤–Ψ―é –Ζ ―è–Κ–Η―Ö ―î –Ζ–Α–Ω―É―¹–Κ ―è–Κ –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ―½, ―²–Α–Κ ―• –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½ ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―•. –£–Α–Κ―Ü–Η–Ϋ–Η –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –î–ù–ö –Ζ–Α–±–Β–Ζ–Ω–Β―΅―É―é―²―¨ –¥–Ψ–≤–≥–Ψ―²―Ä–Η–≤–Α–Μ―É –Β–Κ―¹–Ω―Ä–Β―¹―•―é –Α–Ϋ―²–Η–≥–Β–Ϋ―É ―•, –≤―•–¥–Ω–Ψ–≤―•–¥–Ϋ–Ψ, ―¹―²―•–Ι–Κ―É ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨. –î–Ψ –¥–Ψ–¥–Α―²–Κ–Ψ–≤–Η―Ö ―³–Α–Κ―²–Ψ―Ä―•–≤, ―â–Ψ ―¹–Ω―Ä–Η―è―é―²―¨ ―Ä–Ψ–Ζ–≤–Η―²–Κ―É –î–ù–ö-―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½, –≤―•–¥–Ϋ–Ψ―¹―è―²―¨ –Ω―Ä–Ψ―¹―²–Ψ―²―É –Ι –Ϋ–Η–Ζ―¨–Κ―É –≤–Α―Ä―²―•―¹―²―¨ –≤–Η―Ä–Ψ–±–Ϋ–Η―Ü―²–≤–Α –≤–Α–Κ―Ü–Η–Ϋ–Η[ 51]
–ü–Β―Ä–Β–≤–Α–≥–Η –ù–Β–¥–Ψ–Μ―•–Κ–Η
–ê–Ϋ―²–Η–≥–Β–Ϋ –Ϋ–Α–±―É–≤–Α―î –Ϋ–Α―²–Η–≤–Ϋ–Ψ―½ –Κ–Ψ–Ϋ―³–Ψ―Ä–Φ–Α―Ü―•―½
–ê–Κ―²–Η–≤–Α―Ü―•―è –Ψ–±–Ψ―Ö –≥―•–Μ–Ψ–Κ ―•–Φ―É–Ϋ―•―²–Β―²―É: –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ―½ ―• –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½
–Γ–Η–Ϋ―²–Β–Ζ–Ψ–≤–Α–Ϋ–Η–Ι –Α–Ϋ―²–Η–≥–Β–Ϋ –Φ–Ψ–Ε–Ϋ–Α –≤–Η–±―•―Ä–Κ–Ψ–≤–Ψ –Ϋ–Α–Ω―Ä–Α–≤–Μ―è―²–Η –Ϋ–Α ―à–Μ―è―Ö –€–ù–Γ-I –Α–±–Ψ –€–ù–Γ-II
–€–Ψ–Ε―É―²―¨ –≤–Η–±―•―Ä–Κ–Ψ–≤–Ψ –¥―•―è―²–Η –Ϋ–Α ―Ä―•–Ζ–Ϋ―• –Ω–Ψ–Ω―É–Μ―è―Ü―•―½ –Δ-―Ö–Β–Μ–Ω–Β―Ä―•–≤
–½–Α–±–Β–Ζ–Ω–Β―΅―É―é―²―¨ –¥–Ψ–≤–≥–Ψ―²―Ä–Η–≤–Α–Μ―É –Β–Κ―¹–Ω―Ä–Β―¹―•―é –Α–Ϋ―²–Η–≥–Β–Ϋ―É
–ü―Ä–Ψ―¹―²―• ―• ―à–≤–Η–¥–Κ―• ―É –≤–Η–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ–Ϋ―•
–ù–Η–Ζ―¨–Κ–Α ―Ü―•–Ϋ–Α –≤–Η―Ä–Ψ–±–Ϋ–Η―Ü―²–≤–Α
–ù–Β –Ω–Ψ―²―Ä–Β–±―É―é―²―¨ –Ψ―¹–Ψ–±–Μ–Η–≤–Η―Ö ―É–Φ–Ψ–≤ –Ζ–±–Β―Ä―•–≥–Α–Ϋ–Ϋ―è
–€–Ψ–Ε―É―²―¨ –Ζ–Α―¹―²–Ψ―¹–Ψ–≤―É–≤–Α―²–Η―¹―¨ ―è–Κ –¥–Μ―è –Ω―Ä–Ψ―³―•–Μ–Α–Κ―²–Η–Κ–Η, ―²–Α–Κ ―• –¥–Μ―è –Μ―•–Κ―É–≤–Α–Ϋ–Ϋ―è ―Ö–≤–Ψ―Ä–Ψ–±
–ü–Ψ―²–Β–Ϋ―Ü―•–Ι–Ϋ–Ψ ―î –Β―³–Β–Κ―²–Η–≤–Ϋ–Η–Φ–Η –Ω―Ä–Ψ―²–Η ―à–Η―Ä–Ψ–Κ–Ψ–≥–Ψ ―¹–Ω–Β–Κ―²―Ä–Α ―Ö–≤–Ψ―Ä–Ψ–±: –±–Α–Κ―²–Β―Ä―•–Α–Μ―¨–Ϋ–Η―Ö, –≤―•―Ä―É―¹–Ϋ–Η―Ö, –Α―É―²–Ψ―•–Φ―É–Ϋ–Ϋ–Η―Ö ―• ―Ä–Α–Κ–Ψ–≤–Η―Ö –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ―¨
–Γ–Μ–Α–±–Κ–Α ―•–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Ϋ―•―¹―²―¨
–î–Μ―è –≤―•―Ä―É―¹–Ϋ–Η―Ö –≤–Β–Κ―²–Ψ―Ä―•–≤ ―î –Ϋ–Β–±–Β–Ζ–Ω–Β–Κ–Α ―•–Ϋ―²–Β–≥―Ä–Α―Ü―•―½ ―΅―É–Ε–Ψ―Ä―•–¥–Ϋ–Ψ―½ –î–ù–ö –≤ –≥–Β–Ϋ–Ψ–Φ –Κ–Μ―•―²–Η–Ϋ–Η
–€–Ψ–Ε–Μ–Η–≤–Η–Ι ―Ä–Ψ–Ζ–≤–Η―²–Ψ–Κ –Α―É―²–Ψ―•–Φ―É–Ϋ–Ϋ–Η―Ö ―Ä–Β–Α–Κ―Ü―•–Ι
–ü–Μ–Α–Ζ–Φ―•–¥–Ϋ―• ―• –≤―•―Ä―É―¹–Ϋ―• –≤–Β–Κ―²–Ψ―Ä–Η –Φ–Ψ–Ε―É―²―¨ –≤–Η–Κ–Μ–Η–Κ–Α―²–Η –Ϋ–Β―¹–Ω–Β―Ü–Η―³―•―΅–Ϋ―É ―•–Φ―É–Ϋ–Ϋ―É –≤―•–¥–Ω–Ψ–≤―•–¥―¨
–ü–Β―Ä―à―• –Κ–Μ―•–Ϋ―•―΅–Ϋ―• –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ, ―Ä–Α–Ζ–Ψ–Φ –±–Β–Ζ–Ω–Β―΅–Ϋ―•―¹―²―é –Ϋ–Ψ–≤–Ψ–≥–Ψ –Φ–Β―²–Ψ–¥―É, –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä―É–≤–Α–Μ–Η –Ι–Ψ–≥–Ψ –Ϋ–Η–Ζ―¨–Κ―É –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨. –†–Ψ–Ζ―É–Φ―•―é―΅–Η –Ω–Β―Ä―¹–Ω–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –î–ù–ö-―•–Φ―É–Ϋ―•–Ζ–Α―Ü―•―½, –Ϋ–Α―É–Κ–Ψ–≤―• –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä―•―½ ―Ä–Α–Ζ–Ψ–Φ –Ζ –±―•–Ψ―²–Β―Ö–Ϋ–Ψ–Μ–Ψ–≥―•―΅–Ϋ–Η–Φ–Η –Κ–Ψ–Φ–Ω–Α–Ϋ―•―è–Φ–Η ―¹–Ω―Ä―è–Φ―É–≤–Α–Μ–Η ―¹–≤–Ψ―½ –Ζ―É―¹–Η–Μ–Μ―è –Ϋ–Α –Ψ–Ω―²–Η–Φ―•–Ζ–Α―Ü―•―é –Ϋ–Ψ–≤–Ψ–≥–Ψ –Φ–Β―²–Ψ–¥―É, ―• –≤–Ε–Β –Ζ–Α –Κ―•–Μ―¨–Κ–Α ―Ä–Ψ–Κ―•–≤ –≤–¥–Α–Μ–Ψ―¹―è –¥–Ψ―¹―è–≥―²–Η –Ζ–Ϋ–Α―΅–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–≥―Ä–Β―¹―É. –Θ 2005 ―Ä–Ψ―Ü―• –Ω–Β―Ä―à–Α –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ–Α –Ψ―²―Ä–Η–Φ–Α–Μ–Α –¥–Ψ–Ζ–≤―•–Μ FDA (–Α–Ϋ–≥–Μ. Food and Drug Administration ) –¥–Μ―è –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –Ϋ–Α ―²–≤–Α―Ä–Η–Ϋ–Α―Ö. –Γ―²–Α–Ϋ–Ψ–Φ –Ϋ–Α 2013 ―Ä. –±―•–Μ―¨―à–Β ―¹―²–Α –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –Ω―Ä–Ψ―Ö–Ψ–¥―è―²―¨ –Κ–Μ―•–Ϋ―•―΅–Ϋ―• –≤–Η–Ω―Ä–Ψ–±–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è[ 52]
–Θ―¹―• ―΅–Ψ―²–Η―Ä–Η ―¹―Ö–≤–Α–Μ–Β–Ϋ―• FDA –≤–Α–Κ―Ü–Η–Ϋ–Η ―¹―²–≤–Ψ―Ä–Β–Ϋ―• –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –Ω–Μ–Α–Ζ–Φ―•–¥. –î–Μ―è ―²―Ä―¨–Ψ―Ö ―•–Ζ –Ϋ–Η―Ö ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α–Ϋ–Η–Ι –≤–Η―Ä–Ψ–±–Ϋ–Η–Κ–Ψ–Φ ―¹–Ω–Ψ―¹―•–± –≤–≤–Β–¥–Β–Ϋ–Ϋ―è βÄî –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤–Ψ, –¥–Μ―è –≤–Α–Κ―Ü–Η–Ϋ–Η LifeTide¬° βÄî –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤–Α ―•–Ϋ'―î–Κ―Ü―•―è, –Ω–Ψ―î–¥–Ϋ–Α–Ϋ–Α –Ζ –Β–Μ–Β–Κ―²―Ä–Ψ–Ω–Ψ―Ä–Α―Ü―•―î―é. –·–Κ―â–Ψ ―Ä–Β―à―²–Α –≤–Α–Κ―Ü–Η–Ϋ –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Α –Ϋ–Α –Α–Κ―²–Η–≤–Α―Ü―•―é ―•–Φ―É–Ϋ―•―²–Β―²―É, ―²–Ψ –¥–Μ―è –≤–Α–Κ―Ü–Η–Ϋ–Η LifeTide¬° ―•–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―é―é―΅–Α –¥―•―è ―î –¥–Ψ–¥–Α―²–Κ–Ψ–≤–Ψ―é. –ü―Ä–Ψ–¥―É–Κ―² –≤–Α–Κ―Ü–Η–Ϋ–Η βÄî ―¹–Ψ–Φ–Α―²–Ψ–Μ―•–±–Β―Ä–Η–Ϋ, –≥–Ψ―Ä–Φ–Ψ–Ϋ ―è–Κ–Η–Ι ―¹―²–Η–Φ―É–Μ―é―î –≤–Η–≤―•–Μ―¨–Ϋ–Β–Ϋ–Ϋ―è –≥―•–Ω–Ψ―³―•–Ζ–Ψ–Φ –≥–Ψ―Ä–Φ–Ψ–Ϋ―É ―Ä–Ψ―¹―²―É ―• –Ω―Ä–Ψ–Μ–Α–Κ―²–Η–Ϋ―É . –î―•―è –Ψ―¹―²–Α–Ϋ–Ϋ―•―Ö –¥–≤–Ψ―Ö –≥–Ψ―Ä–Φ–Ψ–Ϋ―•–≤ ―É ―¹–≤–Η–Ϋ–Β–Ι –Ω―Ä–Η–Ζ–≤–Ψ–¥–Η―²―¨ –¥–Ψ –Ζ―Ä–Ψ―¹―²–Α–Ϋ–Ϋ―è –Φ–Α―¹–Η ―²–≤–Α―Ä–Η–Ϋ ―²–Α –Ζ–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è –Κ―•–Μ―¨–Κ–Ψ―¹―²―• –≤–Η–≤–Ψ–¥–Κ―É[ 53] [ 54]
–Δ–Ψ―Ä–≥–Ψ–≤–Α –Ϋ–Α–Ζ–≤–Α –≤–Α–Κ―Ü–Η–Ϋ–Η
–†―•–Κ –Μ―•―Ü–Β–Ϋ–Ζ―É–≤–Α–Ϋ–Ϋ―è
–€―•―à–Β–Ϋ―¨
–Δ–≤–Α―Ä–Η–Ϋ–Α
–ü―Ä–Ψ–¥―É–Κ―² –≤–Α–Κ―Ü–Η–Ϋ–Η
–€–Β―²–Α ―¹―²–≤–Ψ―Ä–Β–Ϋ–Ϋ―è –≤–Α–Κ―Ü–Η–Ϋ–Η
West Nile-Innovator¬° (–Γ–®–ê) [–ê―Ä―Ö―•–≤–Ψ–≤–Α–Ϋ–Ψ 4 –Ε–Ψ–≤―²–Ϋ―è 2013 ―É Wayback Machine .] 2005
–£―•―Ä―É―¹ –≥–Α―Ä―è―΅–Κ–Η –½–Α―Ö―•–¥–Ϋ–Ψ–≥–Ψ –ù―•–Μ―É
–ö–Ψ–Ϋ―•
–Γ―²―Ä―É–Κ―²―É―Ä–Ϋ–Η–Ι –±―•–Μ–Ψ–Κ –≤―•―Ä―É―¹―É PreM-E
–½–Α―Ö–Η―¹―² –Ω―Ä–Ψ―²–Η –≤―•―Ä―É―¹―É
Apex-IHN¬° (–ö–Α–Ϋ–Α–¥–Α) [–ê―Ä―Ö―•–≤–Ψ–≤–Α–Ϋ–Ψ 4 –Ε–Ψ–≤―²–Ϋ―è 2013 ―É Wayback Machine .] 2005
–½–±―É–¥–Ϋ–Η–Κ ―•–Ϋ―³–Β–Κ―Ü―•–Ι–Ϋ–Ψ–≥–Ψ –Ϋ–Β–Κ―Ä–Ψ–Ζ―É –≥–Β–Φ–Ψ–Ω–Ψ–Β―²–Η―΅–Ϋ–Ψ―½ ―²–Κ–Α–Ϋ–Η–Ϋ–Η
–†–Η–±–Η ―Ä–Ψ–¥–Η–Ϋ–Η –¦–Ψ―¹–Ψ―¹–Β–≤―•
–£―•―Ä―É―¹–Ϋ–Η–Ι –≥–Μ―•–Κ–Ψ–Ω―Ä–Ψ―²–Β―½–Ϋ
–ü―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è –Κ―•–Μ―¨–Κ–Ψ―¹―²―• ―• ―è–Κ–Ψ―¹―²―• –Ω―Ä–Ψ–¥–Ψ–≤–Ψ–Μ―¨―¹―²–≤–Α ―Ä–Η–±–Η
LifeTide¬° SW 5 (–ê–≤―¹―²―Ä–Α–Μ―•―è) [–ê―Ä―Ö―•–≤–Ψ–≤–Α–Ϋ–Ψ 9 –≥―Ä―É–¥–Ϋ―è 2012 ―É Wayback Machine .] 2008
–™–Ψ―Ä–Φ–Ψ–Ϋ ―Ä–Ψ―¹―²―É
–Γ–≤–Η–Ϋ―• ―²–Α ―•–Ϋ―à–Α –¥–Ψ–Φ–Α―à–Ϋ―è ―Ö―É–¥–Ψ–±–Α
–Γ–Ψ–Φ–Α―²–Ψ–Μ―•–±–Β―Ä–Η–Ϋ ―¹–≤–Η–Ϋ―•
–½–±―•–Μ―¨―à–Β–Ϋ–Ϋ―è –≤–Η–≤–Ψ–¥–Κ―É ―É ―¹–≤–Η–Ϋ–Ψ–Φ–Α―²–Ψ–Κ; –Ζ–Ϋ–Α―΅–Ϋ–Ψ –Ζ–Ϋ–Η–Ε―É―î –Ζ–Ϋ–Η–Ε–Β–Ϋ–Ϋ―è –Ω–Β―Ä–Η–Ϋ–Α―²–Α–Μ―¨–Ϋ–Ψ―½ ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²―• ―• –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ψ―¹―²―•
ONCEPT¬° (–Γ–®–ê) 2010
–€–Β–Μ–Α–Ϋ–Ψ–Φ–Α
–Γ–Ψ–±–Α–Κ–Η
–Δ–Η―Ä–Ψ–Ζ–Η–Ϋ–Α–Ζ–Α –Μ―é–¥–Η–Ϋ–Η
–·–Κ –Α–Μ―¨―²–Β―Ä–Ϋ–Α―²–Η–≤–Α –Ω―Ä–Ψ–Φ–Β–Ϋ–Β–≤―•–Ι ―²–Β―Ä–Α–Ω―•―½ ―• –Ψ–Ω–Β―Ä–Α―Ü―•–Ι–Ϋ–Ψ–Φ―É –≤―²―Ä―É―΅–Α–Ϋ–Ϋ―é –Ω―Ä–Η –Μ―•–Κ―É–≤–Α–Ϋ–Ϋ―• –Φ–Β–Μ–Α–Ϋ–Ψ–Φ–Η
–†–Ψ–Ζ–Ω–Ψ–¥―•–Μ –≤―•–¥–Κ―Ä–Η―²–Η―Ö –Κ–Μ―•–Ϋ―•―΅–Ϋ–Η―Ö –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ―¨ –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –Ζ–Α–Μ–Β–Ε–Ϋ–Ψ –≤―•–¥ –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ϋ―è ―¹―²–Α–Ϋ–Ψ–Φ –Ϋ–Α 2011 ―Ä―•–Κ. –½–Α–≥–Α–Μ―¨–Ϋ–Α –Κ―•–Μ―¨–Κ―•―¹―²―¨ –≤–Η–Ω―Ä–Ψ–±―É–≤–Α–Ϋ―¨ βÄî 43[ 55]
–Θ ―²–Ψ–Ι ―΅–Α―¹ ―è–Κ ―•–Ϋ–¥―É–Κ―Ü―•―è –Κ–Μ―•―²–Η–Ϋ–Ϋ–Ψ―½ ―• –≥―É–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ―½ ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –Ω–Β―Ä–Β–Κ–Ψ–Ϋ–Μ–Η–≤–Ψ –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Ψ–≤–Α–Ϋ–Α –¥–Μ―è ―΅―É–Ε–Ψ―Ä―•–¥–Ϋ–Η―Ö –Α–Ϋ―²–Η–≥–Β–Ϋ―•–≤, –Α―¹–Ψ―Ü―•–Ι–Ψ–≤–Α–Ϋ–Η―Ö –Ζ ―•–Ϋ―³–Β–Κ―Ü―•–Ι–Ϋ–Η–Φ–Η –Ζ–Α―Ö–≤–Ψ―Ä―é–≤–Α–Ϋ–Ϋ―è–Φ–Η, –Ζ–Α―¹―²–Ψ―¹―É–≤–Α–Ϋ–Ϋ―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ –¥–Μ―è –Μ―•–Κ―É–≤–Α–Ϋ–Ϋ―è ―Ä–Α–Κ―É –¥–Ψ―¹―• –±―É–Μ–Ψ –Φ–Β–Ϋ―à ―É―¹–Ω―•―à–Ϋ–Η–Φ. –Ü–Ϋ–¥―É–Κ―Ü―•―è –Β―³–Β–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―²–Η–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Ψ–≥–Ψ ―•–Φ―É–Ϋ―•―²–Β―²―É ―î ―¹–Κ–Μ–Α–¥–Ϋ–Η–Φ –Ζ–Α–≤–¥–Α–Ϋ–Ϋ―è–Φ. –ö–Μ―•–Ϋ―•―΅–Ϋ―• –¥–Ψ―¹–Μ―•–¥–Ε–Β–Ϋ–Ϋ―è –Ω―•–¥―²–≤–Β―Ä–¥–Η–Μ–Η –Ζ–Α–≥–Α–Μ―¨–Ϋ―É –±–Β–Ζ–Ω–Β–Κ―É ―• –Ϋ–Η–Ζ―¨–Κ―É ―²–Ψ–Κ―¹–Η―΅–Ϋ―•―¹―²―¨ –Ω―Ä–Ψ―²–Η–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Η―Ö –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ, –Ψ–¥–Ϋ–Α–Κ –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –≤–Η–Κ–Μ–Η–Κ–Α–Ϋ–Ψ―½ –Ϋ–Η–Φ–Η ―•–Φ―É–Ϋ–Ϋ–Ψ―½ –≤―•–¥–Ω–Ψ–≤―•–¥―• –≤–Η―è–≤–Η–Μ–Α―¹―è ―¹–Μ–Α–±–Κ–Ψ―é, –Α –Ω―Ä–Ψ―²–Η–Ω―É―Ö–Μ–Η–Ϋ–Ϋ–Α –Α–Κ―²–Η–≤–Ϋ―•―¹―²―¨, –≤ –¥–Β―è–Κ–Η―Ö –≤–Η–Ω–Α–¥–Κ–Α―Ö, –≤–Ζ–Α–≥–Α–Μ―• ―¹―É–Φ–Ϋ―•–≤–Ϋ–Ψ―é[ 40]
–ü―Ä–Η―΅–Η–Ϋ–Ψ―é –Κ–Α―Ä―•―î―¹―É ―î –Μ–Ψ–Κ–Α–Μ―¨–Ϋ–Α –Ζ–Φ―•–Ϋ–Α pH –≤–Ϋ–Α―¹–Μ―•–¥–Ψ–Κ –±―Ä–Ψ–¥―•–Ϋ–Ϋ―è (–≥–Μ―•–Κ–Ψ–Μ―•–Ζ―É) –≤―É–≥–Μ–Β–≤–Ψ–¥―•–≤ , –Ζ–¥―•–Ι―¹–Ϋ―é–≤–Α–Ϋ–Ψ–≥–Ψ –±–Α–Κ―²–Β―Ä―•―è–Φ–Η [ 56] Streptococcus mutans . –£–Α–Κ―Ü–Η–Ϋ–Α –Ω–Ψ–±―É–¥–Ψ–≤–Α–Ϋ–Α –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤―• –Ω–Μ–Α–Ζ–Φ―•–¥–Η ―• –Κ–Ψ–¥―É―î –¥–≤–Α –±―•–Μ–Κ–Η: –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Β–≤–Η–Ι –Ω―Ä–Ψ―²–Β―½–Ϋ St. mutans PAc ―²–Α ―³–Μ–Α–≥–Β–Μ―•–Ϋ , –Ψ―²―Ä–Η–Φ–Α–Ϋ–Η–Ι –Ζ –±–Α–Κ―²–Β―Ä―•―½ Salmonella , ―è–Κ–Η–Ι –≤–Η–Κ–Ψ–Ϋ―É―î ―Ä–Ψ–Μ―¨ –Α–¥'―é–≤–Α–Ϋ―²–Α[ 57] Streptococcus mutans –Ϋ–Α –Ζ―É–±–Ϋ―•–Ι –Β–Φ–Α–Μ―•. –Δ–Ψ–±―²–Ψ, –Ζ―É–±–Η –≤–Α–Κ―Ü–Η–Ϋ–Ψ–≤–Α–Ϋ–Η―Ö ―²–≤–Α―Ä–Η–Ϋ –±―É–Μ–Η –Κ―Ä–Α―â–Β –Ζ–Α―Ö–Η―â–Β–Ϋ―• –≤―•–¥ –Κ–Α―Ä―•―î―¹―É.
–Π―É–Κ―Ä–Ψ–≤–Η–Ι –¥―•–Α–±–Β―² ―²–Η–Ω―É 1 ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―î―²―¨―¹―è –≤―²―Ä–Α―²–Ψ―é ―•–Ϋ―¹―É–Μ―•–Ϋ-–Ω―Ä–Ψ–¥―É–Κ―É―é―΅–Η―Ö –±–Β―²–Α-–Κ–Μ―•―²–Η–Ϋ, ―Ä–Ψ–Ζ―²–Α―à–Ψ–≤–Α–Ϋ–Η―Ö –≤ –Ψ―¹―²―Ä―•–≤―Ü―è―Ö –¦–Α–Ϋ–≥–Β―Ä–≥–Α–Ϋ―¹–Α –Ω―•–¥―à–Μ―É–Ϋ–Κ–Ψ–≤–Ψ―½ –Ζ–Α–Μ–Ψ–Ζ–Η. –™–Ψ–Μ–Ψ–≤–Ϋ–Α –Ω―Ä–Η―΅–Η–Ϋ–Α –≤―²―Ä–Α―²–Η –±–Β―²–Α-–Κ–Μ―•―²–Η–Ϋ βÄî –Α―É―²–Ψ―•–Φ―É–Ϋ–Ϋ–Β ―É―Ä–Α–Ε–Β–Ϋ–Ϋ―è –Δ-–Κ―•–Μ–Β―Ä–Α–Φ–Η[ 58] –Ω―Ä–Ψ―•–Ϋ―¹―É–Μ―•–Ϋ . –Π–Β –≤–Α–Κ―Ü–Η–Ϋ–Α –Ζ–≤–Ψ―Ä–Ψ―²–Ϋ–Ψ―½ –¥―•―½: ―è–Κ―â–Ψ –Ζ–≤–Η―΅–Α–Ι–Ϋ―• –≤–Α–Κ―Ü–Η–Ϋ–Η –Ω–Ψ–≤–Η–Ϋ–Ϋ―• –Α–Κ―²–Η–≤―É–≤–Α―²–Η ―•–Φ―É–Ϋ–Ϋ―• ―Ä–Β–Α–Κ―Ü―•―½, ―²–Ψ BHT-3021, –Ϋ–Α–≤–Ω–Α–Κ–Η, –Ϋ–Β–Ι―²―Ä–Α–Μ―•–Ζ―É―î ―Ü–Η―²–Ψ―²–Ψ–Κ―¹–Η―΅–Ϋ―É –¥―•―é –Δ-–Κ―•–Μ–Β―Ä―•–≤ –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ―É –Ω―Ä–Ψ―²–Η –Ψ―¹―²―Ä―•–≤―Ü―•–≤ –¦–Α–Ϋ–≥–Β―Ä–≥–Α–Ϋ―¹–Α.
–Θ –Ω–Β―Ä―à―•–Ι ―³–Α–Ζ―• –Κ–Μ―•–Ϋ―•―΅–Ϋ–Η―Ö –≤–Η–Ω―Ä–Ψ–±―É–≤–Α–Ϋ―¨ BHT-3021 –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Α ―¹–≤–Ψ―é –Β―³–Β–Κ―²–Η–≤–Ϋ―•―¹―²―¨ –Ϋ–Α –≥―Ä―É–Ω―• 80 –Ψ―¹―•–±. –ü–Ψ–Μ–Ψ–≤–Η–Ϋ–Α –Ζ –Ϋ–Η―Ö –Κ–Ψ–Ε–Ϋ–Η―Ö ―¹―•–Φ –¥–Ϋ―•–≤ –Ω―Ä–Ψ―²―è–≥–Ψ–Φ 12 ―²–Η–Ε–Ϋ―•–≤ –Ψ―²―Ä–Η–Φ―É–≤–Α–Μ–Α –≤–Ϋ―É―²―Ä―•―à–Ϋ―¨–Ψ–Φ'―è–Ζ–Ψ–≤―• ―•–Ϋ'―î–Κ―Ü―•―½ BHT-3021, –Α –¥―Ä―É–≥–Α –Ω–Ψ–Μ–Ψ–≤–Η–Ϋ–Α βÄî –Ω–Μ–Α―Ü–Β–±–Ψ . –ü―•―¹–Μ―è –Ζ–Α–Κ―•–Ϋ―΅–Β–Ϋ–Ϋ―è ―Ü―¨–Ψ–≥–Ψ ―²–Β―Ä–Φ―•–Ϋ―É –≥―Ä―É–Ω–Α, ―è–Κ–Α –Ψ―²―Ä–Η–Φ―É–≤–Α–Μ–Α –≤–Α–Κ―Ü–Η–Ϋ―É, –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä―É–≤–Α–Μ–Α –Ω―•–¥–≤–Η―â–Β–Ϋ–Ϋ―è ―Ä―•–≤–Ϋ―è –Γ-–Ω–Β–Ω―²–Η–¥―•–≤ –≤ –Κ―Ä–Ψ–≤―•, ―â–Ψ ―¹–≤―•–¥―΅–Η―²―¨ –Ω―Ä–Ψ –≤―•–¥–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ϋ―è ―³―É–Ϋ–Κ―Ü―•―½ –±–Β―²–Α-–Κ–Μ―•―²–Η–Ϋ. –ù―•―è–Κ–Η―Ö ―¹–Β―Ä–Ι–Ψ–Ζ–Ϋ–Η―Ö –Ω–Ψ–±―•―΅–Ϋ–Η―Ö –Β―³–Β–Κ―²―•–≤ ―É –Ε–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ζ ―É―΅–Α―¹–Ϋ–Η–Κ―•–≤ –Ζ–Α―³―•–Κ―¹–Ψ–≤–Α–Ϋ–Ψ –Ϋ–Β –±―É–Μ–Ψ. –î―•―è –≤–Α–Κ―Ü–Η–Ϋ–Η –Ζ–±–Β―Ä―•–≥–Α–Μ–Α―¹―¨ –Ω―Ä–Ψ―²―è–≥–Ψ–Φ 2 –Φ―•―¹―è―Ü―•–≤[ 59]
βÜë Atanasiu P.; Cantarow A., Paschkis K. E. (1950). Production of neoplasms by fractions of mammalian neoplasms . Cancer Res . 10 : 775βÄî782. βÜë Ito Y. (1961). Heat-resistance of the tumongenic nucleic acids of Shope papillomatous. Virology . 12 : 596βÄî601. βÜë Atanasiu P. (1962). Production de tureurs chez le Hamster par
inoculation dβÄôacide desoxyribonucleique extrait de cultures de
tissus infectees par le virus du polyome. Acad. Sci . 254 : 4228βÄî4230. βÜë Orth G. (1964). Infectious and oncogenic effect of DNA extracted from cells infected with polyoma virus. PrOC. Soc. Exp. Biol. Med . 115 : 1090βÄî1095. βÜë Wolff J. A.; Malone R. W., Williams P., Chong W. (1990). Direct gene transfer into mouse muscle in vivo. Science . 247 (4949): 1465βÄî1468. PMID 1690918 . βÜë Tang D.; Devit M.; Johnston S.A.; Others, (1992). Genetic immunization is a simple method for eliciting an immune response. Nature . 356 (6365): 152βÄî154. doi :10.1038/356152a0 . PMID 1545867 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Ulmer J. B.; Donnelly J., Parker S. E., Rhodes, Others, (1993). Heterologous protection against influenza by injection of DNA encoding a viral protein. Science . 259 : 1745βÄî1749. {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Wang B; Ugen K. E., Srikantan V., Agadjanyan M. G.; Others, (1992). Gene inoculation generates immune responses against human immunodeficiency virus type 1. Proc Natl Acad Sci U S A . 90 (9): 4156βÄî4160. doi :10.1073/pnas.90.9.4156 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Conry R. M.; LoBuglio, A. F., Loechel, F., Moore, S. E.; Others, (1995). A carcinoembryonic antigen polynucleotide vaccine for human clinical use. Cancer gene therapy . 2 (1): 33βÄî38. {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Chattergoon M; Boyer J, Weiner DB. (1997). Genetic immunization: a new era in vaccines and immune therapeutics . FASEB J . 11 (10): 753βÄî763. PMID 9271360 . βÜë Ferraro B.; Matthew P. Morrow, Natalie A. Hutnick; Others (2011). Clinical Applications of DNA Vaccines: Current Progress. Clin Infect Dis . 53 (3): 296βÄî302. doi :10.1093/cid/cir334 . βÜë Anderson R. J.; Schneider J. (2007). Plasmid DNA and viral vector-based vaccines for the treatment of cancer. Vaccine . 25 : 24βÄî34. doi :10.1016/j.vaccine.2007.05.030. βÜë –Α –± –≤ –≥ Garmory H. S.; Brown K. A., Titball R. W. (2003). DNA vaccines: improving expression of antigens. Genetic vaccines and therapy . 1 . doi :10.1186/1479-0556-1-2 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë –Γ―É–Ω–Ψ―²–Ϋ–Η―Ü–Κ–Η–Ι –€. –£. (1998). –î–ù–ö-–Η–Φ–Φ―É–Ϋ–Η–Ζ–Α―Ü–Η―è –≤ –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Β –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι ―¹–Β–Μ―¨―¹–Κ–Ψ―Ö–Ψ–Ζ―è–Ι―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö βÄ™ 1998. βÄ™ –Δ. 5. βÄ™ –Γ. 18-24 . –£–Β―²–Β―Ä–Η–Ϋ–Α―Ä–Η―è . 5 : 18βÄî24. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 7 –≥―Ä―É–¥–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 19 –≤–Β―Ä–Β―¹–Ϋ―è 2013 . βÜë –Α –± Rice J.; Dossett M. L., Ohlen C., Buchan S. L., Others (2008). DNA fusion gene vaccination mobilizes effective
anti-leukemic cytotoxic T lymphocytes from a tolerized
repertoire. European Journal of Immunology . 38 (8): 2118βÄî2129. doi :10.1002/eji.200838213 . βÜë –Α –± –≤ –≥ Kamimura K.; Suda T., Zhang G., Liu D. (2011). Advances in gene delivery systems. Pharmaceutical medicine . 5 : 293βÄî306. PMID PMC3245684 . βÜë Wolff J. A.; Ludtke JJ, Acsadi G, Williams P, Jani A (1992). Long-term persistence of plasmid DNA and foreign gene expression in mouse muscle. Hum. Mol. Gen . 1 : 363βÄî369. βÜë –Α –± –≤ –≥ Cranenburgh R. (2011). DNA Vaccine Delivery . BioPharm International Supplements . 24 (10): 12βÄî18. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 19 –≤–Β―Ä–Β―¹–Ϋ―è 2013 . βÜë Chen X; Kask A. S., Crichton M. L., Others, (2010). Improved DNA vaccination by skin-targeted delivery using dry-coated densely-packed microprojection arrays. J. Control. Release 148 (3): 327βÄî333. doi :10.1016/j.jconrel.2010.09.001 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Chen C.; Evans J. A., Robinson M. P., Others, (2010). Genetic immunization is a simple method for eliciting an immune response. Physics in Medicine and Biology . 55 (4): 1219βÄî1223. doi :10.1088/0031-9155/55/4/021 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Kjeken R.; Devit M.; Johnston S.A.; Others, (2008). Recruitment of antigen-presenting cells to the site of inoculation and augmentation of human immunodeficiency virus type 1 DNA vaccine immunogenicity by in vivo electroporation . Journal of Virology . 82 (11): 5643βÄî5649. doi :10.1128/JVI.02564-07 . PMID 1545867 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Fechheimer M.; Boylan J. F., Parker S., Others, (1987). Transfection of mammalian cells with plasmid DNA by scrape loading and sonication loading. Proc Natl Acad Sci U S A . 84 (23): 8463βÄî8467. PMID 2446324 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë –ê–±―Ä–Α–Φ–Ψ–≤–Α, –½.–‰. (2008), –£–≤–Β–¥–Β–Ϋ–Η–Β –≤ –≥–Β–Ϋ–Β―²–Η―΅–Β―¹–Κ―É―é –Η–Ϋ–Ε–Β–Ϋ–Β―Ä–Η―é (PDF) , –ö–Α–Ζ–Α–Ϋ―¨, ―¹. 110βÄî116, –Α―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É (PDF) –Ζ–Α 2 –Ε–Ψ–≤―²–Ϋ―è 2013, –Ω―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 29 –≤–Β―Ä–Β―¹–Ϋ―è 2013 βÜë Klein, TM et al (1987) High-velocity microprojectiles for delivering nucleic acids into living cells [–ê―Ä―Ö―•–≤–Ψ–≤–Α–Ϋ–Ψ 27 –≤–Β―Ä–Β―¹–Ϋ―è 2013 ―É Wayback Machine .] . Nature 327:70-73
βÜë Liu F; Song Y, Liu D. (1999). Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther . 6 (7): 1258βÄî66. doi :10.1038/356152a0 . PMID 10455434 . βÜë [[[Jet injector]][en] Wikipedia: Jet injector ] βÜë Kumaragurubaran K.; Kaliaperumal K. (2013). DNA vaccine: the miniature miracle. Vet World . 6 (4): 228βÄî232. doi :10.5455/vetworld.2013.228-232 . βÜë Taberner A.; Devit M., Hogan C. N., Hunter I. W. (2012). Needle-free jet injection using real-time controlled linear Lorentz-force actuators. Medical engineering & physics . 34 (9): 1228βÄî1235. doi :10.1016/j.medengphy.2011.12.010 . βÜë Gentschev I,; Dietrich G, Spreng S, Pilgrim S, Stritzker J, Kolb-MΟΛurer A, Goebel W. (2002). Delivery of protein antigens and DNA by attenuated intracellular bacteria. Int J Med Microbiol . 291 : 577βÄî582. PMID 11890559 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Balazs D. A.; Godbey W. T. (2011). Liposomes for Use in Gene Delivery. Journal of Drug Delivery . 2011 : 12. doi :10.1155/2011/326497 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë
–£–Β–Μ–Η–Κ–Η–Ι –€–Η–Κ–Ψ–Μ–Α, –™–Β–Ϋ–Ϋ–Α ―²–Β―Ä–Α–Ω―•―è: –¥–Ψ―¹―è–≥–Ϋ–Β–Ϋ–Ϋ―è, –Ω–Β―Ä―¹–Ω–Β–Κ―²–Η–≤–Η –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013, –Ω―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 19 –≤–Β―Ä–Β―¹–Ϋ―è 2013
βÜë Ananthaswamy, Anil (20 –±–Β―Ä–Β–Ζ–Ϋ―è 2003). Undercover genes slip into the brain . New Scientist. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 17 –≤–Β―Ä–Β―¹–Ϋ―è 2011. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 17 ―¹–Β―Ä–Ω–Ϋ―è 2010 . βÜë Moghimi S. M.; Hunter A. C., Murray J. C. (2005). Nanomedicine: current status and future prospects . The FASEB Journal . 19 : 311βÄî330. doi :10.1096/fj.04-2747rev . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë –î―É―Ä―΄–Φ–Α–Ϋ–Ψ–≤ –€–Η―Ö–Α–Η–Μ, –î–Ψ―¹―²–Α–≤–Κ–Α –≥–Β–Ϋ–Ψ–≤ –≤ –Κ–Μ–Β―²–Κ―É –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013, –Ω―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 19 –≤–Β―Ä–Β―¹–Ϋ―è 2013 βÜë –Α –± –≤ –Γ―²–Α―Ä–Ψ–¥―É–±–Ψ–≤–Α –ï. –Γ.; –‰―¹–Α–≥―É–Μ―è–Ϋ―Ü –€. –™., –ö–Α―Ä–Ω–Ψ–≤ –£. –¦. (2010). –†–Β–≥―É–Μ―è―Ü–Η―è –Ω―Ä–Ψ―Ü–Β―¹―¹–Η–Ϋ–≥–Α –Η–Φ–Φ―É–Ϋ–Ψ–≥–Β–Ϋ–Α: ―¹–Η–≥–Ϋ–Α–Μ―¨–Ϋ―΄–Β –Ω–Ψ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Η –Η―Ö –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –¥–Μ―è ―¹–Ψ–Ζ–¥–Α–Ϋ–Η―è –Ϋ–Ψ–≤–Ψ–≥–Ψ –Ω–Ψ–Κ–Ψ–Μ–Β–Ϋ–Η―è –î–ù–ö-–≤–Α–Κ―Ü–Η–Ϋ. ACTA NATURAE . 2 (1): 59βÄî65. βÜë Klionsky D.; Emr. S. (2000). Autophagy as a regulated pathway of cellular degradation. Science . 290 : 1717βÄî1721. doi :10.1126/science.290.5497.1717 . βÜë –Α –± Tang D.; Weiner D. B. (2008). DNA vaccines: ready for prime time?. Nature Reviews Genetics . 9 (10): 776βÄî788. doi :10.1038/nrg2432 . βÜë Williams J.A. (2013). Vector Design for Improved DNA Vaccine Efficacy, Safety and Production. Vaccines . 1 (3): 225βÄî249. doi :10.3390/vaccines1030225 . PMID 1545867 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë –Α –±
Moreno S; Timon M. (2004). DNA vaccination: an immunological perspective (PDF) . Immunologia . 123 : 41βÄî55. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É (PDF) –Ζ–Α 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 20 –≤–Β―Ä–Β―¹–Ϋ―è 2013 .
βÜë –Α –± Shaw D. R.; Strong T. V. (2006). DNA vaccines for cancer . Frontiers in Bioscience . 11 : 1189βÄî1198. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 20 –≤–Β―Ä–Β―¹–Ϋ―è 2013 . βÜë Chudley L.; McCann K., Mander A., Tjelle T., Others (2012). DNA fusion-gene vaccination in patients with prostate cancer
induces high-frequency CD8+
T-cell responses and increases
PSA doubling time. Cancer Immunol Immunother . 61 : 2161βÄî2170. doi :10.1002/eji.200838213 . βÜë Ulmer J. B.; Wahren B., Liu M. A. (2006). Dna vaccines: recent technological and clinical advanced . Discovery Medicine, 6(33):109-112, 2006 . 6 (33): 109βÄî112. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 26 –≤–Β―Ä–Β―¹–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 21 –≤–Β―Ä–Β―¹–Ϋ―è 2013 . βÜë Coley, WB (1991). The treatment of malignant tumors by repeated inoculations of erysipelas. With a report of ten original cases. 1893. Clinical orthopaedics and related research (262): 3βÄî11. PMID 1984929 . βÜë Krieg, AM; Yi, AK; Matson, S; Waldschmidt, TJ; Bishop, GA; Teasdale, R; Koretzky, GA; Klinman, DM (1995). CpG motifs in bacterial DNA trigger direct B-cell activation. Nature . 374 (6522): 546βÄî9. doi :10.1038/374546a0 . PMID 7700380 . βÜë Entrez Gene: TLR9 toll-like receptor 9 .βÜë Thalhamer, Josef; Weiss, Richard; Scheiblhofer, Sandra (2010), Gene Vaccines Springer , ―¹. 198βÄî203, doi :10.1007/978-3-7091-0439-2 βÜë Hong Qin; Pramod N. Nehete, Hong He, Others, (2010). Prime-Boost Vaccination Using Chemokine-Fused gp120 DNA and HIV Envelope Peptides Activates Both Immediate and Long-Term Memory Cellular Responses in Rhesus Macaques. Journal of Biomedicine and Biotechnology . 2010 : 152βÄî154. doi :10.1155/2010/860160 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è ) –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Igoucheva, O; Grazzini M., Pidich A., Others, (2013). Immunotargeting and eradication of orthotopic melanoma using a chemokine-enhanced DNA vaccine. Gene Therapy . 20 (9): 938βÄî949. doi :10.1038/gt.2013.17 . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë –ï–≤–¥–Ψ–Ϋ–Η–Ϋ –ê. –¦.; –€–Β–¥–≤–Β–¥–Β–≤–Α –ù. –î. (2009). –£–Ϋ–Β–Κ–Μ–Β―²–Ψ―΅–Ϋ―΄–Ι –±–Β–Μ–Ψ–Κ ―²–Β–Ω–Μ–Ψ–≤–Ψ–≥–Ψ ―à–Ψ–Κ–Α 70 –Η –Β–≥–Ψ ―³―É–Ϋ–Κ―Ü–Η–Η. –Π–Η―²–Ψ–Μ–Ψ–≥–Η―è . 51 (2): 130βÄî137. βÜë Ebrahimi S. M.; Tebianian M. (2013). Immunotargeting and eradication of orthotopic melanoma using a chemokine-enhanced DNA vaccine (PDF) . World Applied Sciences Journal . 14 (10): 1569βÄî1575. –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É (PDF) –Ζ–Α 29 –≤–Β―Ä–Β―¹–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 22 –≤–Β―Ä–Β―¹–Ϋ―è 2013 . βÜë Liu, Margaret A. (2011). DNA vaccines: an historical perspective and view to the future. Immunological Reviews . 239 (1): 62βÄî84. doi :10.1111/j.1600-065X.2010.00980.x . ISSN 0105-2896 . βÜë ClinicalTrial.gov: A service of the U.S. National Institutes of Health . –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 11 ―΅–Β―Ä–≤–Ϋ―è 2015. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 6 –Ε–Ψ–≤―²–Ϋ―è 2013 .βÜë Draghia-Akli R.; Ellis K. M., Hill L.-A., P.; Others, (2003). High-efficiency growth hormone releasing hormone plasmid vector administration into skeletal muscle mediated by electroporation in pigs. FASEB J . doi :10.1096/fj.02-0671fje . {{cite journal }}: –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η –Ζ –Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è–Φ–Η –Ϋ–Α –¥–Ε–Β―Ä–Β–Μ–Α ―•–Ζ –Ζ–Α–Ι–≤–Ψ―é –Ω―É–Ϋ–Κ―²―É–Α―Ü―•―î―é (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è ) –û–±―¹–Μ―É–≥–Ψ–≤―É–≤–Α–Ϋ–Ϋ―è CS1: –Γ―²–Ψ―Ä―•–Ϋ–Κ–Η ―•–Ζ –Ϋ–Β–Ω–Ψ–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Φ DOI –Ζ –±–Β–Ζ–Κ–Ψ―à―²–Ψ–≤–Ϋ–Η–Φ –¥–Ψ―¹―²―É–Ω–Ψ–Φ (–Ω–Ψ―¹–Η–Μ–Α–Ϋ–Ϋ―è )βÜë Brown P. A.; Davis W. C., Draghia-Akli R. (1992). Immune-enhancing effects of growth hormone-releasing hormone delivered by plasmid injection and electroporation. Mol Ther . 10 (4): 644βÄî651. doi :10.1038/356152a0 . PMID 15451448 . βÜë Ferraro B.; Morrow, M. P., Hutnick, N. A. (2011). Clinical applications of DNA vaccines: current progress. Clinical infectious diseases . 53 (3): 296βÄî303. doi :10.1093/cid/cir334 . βÜë Introduction To Dental Plaque (–Α–Ϋ–≥–Μ―•–Ι―¹―¨–Κ–Ψ―é) . –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 24 ―¹–Β―Ä–Ω–Ϋ―è 2011. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 17 –±–Β―Ä–Β–Ζ–Ϋ―è 2009 .βÜë Shi W. ―²–Α ―•–Ϋ. (2012). Flagellin enhances saliva IgA response and protection of anti-caries DNA vaccine . Journal of dental research . 91 (3): 249βÄî254. βÜë Type 1 Diabetes Mellitus . –ê―Ä―Ö―•–≤ –Ψ―Ä–Η–≥―•–Ϋ–Α–Μ―É –Ζ–Α 21 –Μ–Η–Ω–Ϋ―è 2013. –ü―Ä–Ψ―Ü–Η―²–Ψ–≤–Α–Ϋ–Ψ 4 ―¹–Β―Ä–Ω–Ϋ―è 2008 .βÜë Roep B. O.; Solvason, N., Gottlieb, P. A., Abreu, J. R. (2013). Plasmid encoded proinsulin preserves C-peptide while specifically reducing proinsulin-specific CD8 T cells in type 1 diabetes. Sci Transl Med . 5 (191): 191-82. doi :10.1126/scitranslmed.3006103 .