| Атомний номер |
 |
| Розмірність |
 |
|---|
| Символ величини (LaTeX) |
 |
|---|
| Рекомендована одиниця вимірювання |
1[1] |
|---|
| Є кількістю |
протон |
|---|
А́томний но́мер (протонне число, зарядове число, порядковий номер, Z) — властивість атома (нукліда, атомного ядра), яка вказує на загальну кількість протонів, що містяться в його ядрі, отже одночасно вказує на його заряд в одиницях елементарного заряду, а також на порядкове місце хімічного елемента в періодичній системі хімічних елементів. Позначається здебільшого символом Z.
Атомний номер — основний ідентифікатор хімічного елемента.
Загальні відомості
Термін «атомний» або «порядковий» номер застосовується переважно у хімії та атомній фізиці, а еквівалентний термін «зарядове число» — в ядерній фізиці[2]. В атомі, що має нейтральний заряд (тобто не є йоном), кількість електронів дорівнює атомному номеру.
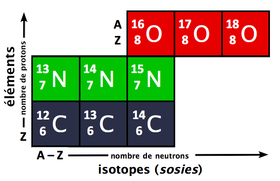
Нукліди що мають однаковий атомний номер, є представниками одного хімічного елемента, при цьому якщо вони різняться за нуклонним числом A (точніше: мають однакове протонне число Z, але різне нейтронне число N) — вони є різними ізотопами того ж самого хімічного елемента.
Спочатку атомний номер означав місце елемента в періодичній таблиці. При впорядковуванні відомих хімічних елементів за подібністю їх хімічних властивостей, було помічено, що впорядкування їх лише за величиною їх атомних мас призводить до певних невідповідностей. Так йод і телур, якщо їх поставити за їх атомними масами, йтимуть у неправильному порядку. Вони значно краще вписуються в таблицю, якщо їх поміняти місцями.
Аномалії в послідовності врешті пояснив Генрі Мозлі (Henry Gwyn Jeffreys Moseley). У 1913 році Мозлі відкрив жорстку залежність між рентгенівським дифракційним спектром елементів та їхнім місцем у періодичній таблиці. У 1920 році англійський фізик Дж. Чедвік експериментально підтвердив гіпотезу Ван ден Брука про збіжність атомного номера елемента з величиною позитивного заряду ядра атома, інакше кажучи, числом протонів. Тим самим був розкритий фізичний зміст порядкового номера елемента в Періодичній системі. Періодичний закон отримав сучасне формулювання: «Властивості простих речовин, а також форми і властивості сполук елементів знаходяться в періодичній залежності від зарядів ядер атомів елементів».
Розміщення, що якнайточніше відповідало хімічним властивостям, було розміщенням за атомним номером. Цей номер близько пропорційний до атомної маси, але є розбіжності, що відбивають деяку іншу властивість, аніж масу.
Атомний номер близько пов'язаний з масовим числом (хоча їх не слід плутати), що є сумою протонів та нейтронів у ядрі. Атомний номер записують у вигляді нижнього індексу перед символом хімічного елемента (наприклад, 6C), а масове число часто пишуть після назви елемента (наприклад, вуглець-14).
Джерела
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
Примітки
Див. також