|
–ö–ĺ—Ą–į–ļ—ā–ĺ—Ä F430
| –ö–ĺ—Ą–į–ļ—ā–ĺ—Ä F430 |
|---|
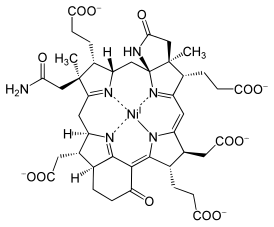 |
| –•–ł–ľ. —Ą–ĺ—Ä–ľ—É–Ľ–į |
C42H51N5NiO13‚Äď |
| –ú–ĺ–Ľ—Ź—Ä–Ĺ–į—Ź –ľ–į—Ā—Ā–į |
906.58014 –≥/–ľ–ĺ–Ľ—Ć |
| –†–Ķ–≥. –Ĺ–ĺ–ľ–Ķ—Ä CAS |
73145-13-8 |
| PubChem |
5460020 |
| SMILES |
|
| InChI |
InChI=1S/C42H52N6O13.Ni/c1-40(16-30(43)50)22(5-9-33(54)55)27-15-42-41(2,17-31(51)48-42)23(6-10-34(56)57)26(47-42)13-24-20(11-35(58)59)19(4-8-32(52)53)39(45-24)37-28(49)7-3-18-21(12-36(60)61)25(46-38(18)37)14-29(40)44-27;/h13,18-23,25,27H,3-12,14-17H2,1-2H3,(H9,43,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61);/p-1/t18-,19-,20-,21-,22+,23+,25+,27-,40-,41-,42-;/m0./s1 |
| ChEBI |
28265 |
| ChemSpider |
4573710 |
| –ü—Ä–ł–≤–Ķ–ī–Ķ–Ĺ—č –ī–į–Ĺ–Ĺ—č–Ķ –ī–Ľ—Ź —Ā—ā–į–Ĺ–ī–į—Ä—ā–Ĺ—č—Ö —É—Ā–Ľ–ĺ–≤–ł–Ļ (25 ¬įC, 100 –ļ–ü–į), –Ķ—Ā–Ľ–ł –Ĺ–Ķ —É–ļ–į–∑–į–Ĺ–ĺ –ł–Ĺ–ĺ–Ķ. |  –ú–Ķ–ī–ł–į—Ą–į–Ļ–Ľ—č –Ĺ–į –í–ł–ļ–ł—Ā–ļ–Ľ–į–ī–Ķ –ú–Ķ–ī–ł–į—Ą–į–Ļ–Ľ—č –Ĺ–į –í–ł–ļ–ł—Ā–ļ–Ľ–į–ī–Ķ |
F430 ‚ÄĒ –Ņ—Ä–ĺ—Ā—ā–Ķ—ā–ł—á–Ķ—Ā–ļ–į—Ź –≥—Ä—É–Ņ–Ņ–į —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į –ľ–Ķ—ā–ł–Ľ–ļ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā-–ú-—Ä–Ķ–ī—É–ļ—ā–į–∑—č. –Ď—č–Ľ –ĺ–Ī–Ĺ–į—Ä—É–∂–Ķ–Ĺ –≤ –ľ–Ķ—ā–į–Ĺ–ĺ–≥–Ķ–Ĺ–Ĺ—č—Ö –ź—Ä—Ö–Ķ—Ź—Ö[1].
–≠—ā–ĺ—ā —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā –ļ–į—ā–į–Ľ–ł–∑–ł—Ä—É–Ķ—ā –≤—č—Ā–≤–ĺ–Ī–ĺ–∂–ī–Ķ–Ĺ–ł–Ķ –ľ–Ķ—ā–į–Ĺ–į –Ĺ–į —Ą–ł–Ĺ–į–Ľ—Ć–Ĺ–ĺ–Ļ —Ā—ā–į–ī–ł–ł –ľ–Ķ—ā–į–Ĺ–ĺ–≥–Ķ–Ĺ–Ķ–∑–į:
CH3-S-CoM + HS-CoB ‚Üí CH4 + CoB-S-S-CoM
–ö–ĺ—Ä—Ą–ł–Ĺ –≤ –ļ–ĺ–Ĺ—ā–Ķ–ļ—Ā—ā–Ķ –ī—Ä—É–≥–ł—Ö —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ–ĺ–≤
–ü—Ä–ł—Ä–ĺ–ī–į –ł—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ—ā —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ—č ‚ÄĒ –≥–Ķ–ľ—č, —Ö–Ľ–ĺ—Ä–ĺ—Ą–ł–Ľ–Ľ –ł –ļ–ĺ–Ī–į–Ľ–į–ľ–ł–Ĺ. F430 ‚ÄĒ —Ā–į–ľ—č–Ļ –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ—č–Ļ –ł–∑ –Ņ—Ä–ł—Ä–ĺ–ī–Ĺ—č—Ö —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ–ĺ–≤ ‚ÄĒ –≤ –Ĺ—Ď–ľ –≤—Ā–Ķ–≥–ĺ –Ņ—Ź—ā—Ć –ī–≤–ĺ–Ļ–Ĺ—č—Ö —Ā–≤—Ź–∑–Ķ–Ļ. –≠—ā–ĺ –ł—Ā–ļ–Ľ—é—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ķ —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–Ķ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–Ĺ–ĺ–Ķ –Ĺ–į–∑—č–≤–į–Ķ—ā—Ā—Ź –ļ–ĺ—Ä—Ą–ł–Ĺ–ĺ–ľ. –ė–∑-–∑–į –ĺ—ā–Ĺ–ĺ—Ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ļ–į —Ā–ĺ–Ņ—Ä—Ź–∂—Ď–Ĺ–Ĺ—č—Ö —Ā–≤—Ź–∑–Ķ–Ļ, –ĺ–Ĺ –∂—Ď–Ľ—ā—č–Ļ, –į –Ĺ–Ķ —Ź—Ä–ļ–ĺ –Ņ—É—Ä–Ņ—É—Ä–Ĺ–ĺ-–ļ—Ä–į—Ā–Ĺ—č–Ļ, —á—ā–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–Ĺ–ĺ –ī–Ľ—Ź –Ī–ĺ–Ľ–Ķ–Ķ –Ĺ–Ķ–Ĺ–į—Ā—č—Č–Ķ–Ĺ–Ĺ—č—Ö —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ–ĺ–≤. –≠—ā–ĺ —ā–į–ļ–∂–Ķ –Ķ–ī–ł–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ —ā–Ķ—ā—Ä–į–Ņ–ł—Ä—Ä–ĺ–Ľ—Ć–Ĺ–ĺ–Ķ –Ņ—Ä–ĺ–ł–∑–≤–ĺ–ī–Ĺ–ĺ–Ķ, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–ł–Ķ –Ĺ–ł–ļ–Ķ–Ľ—Ć. Ni(II) —Ā–Ľ–ł—ą–ļ–ĺ–ľ –ľ–į–Ľ –ī–Ľ—Ź N4 —Ā–≤—Ź–∑—č–≤–į—é—Č–Ķ–≥–ĺ —Ā–į–Ļ—ā–į –ļ–ĺ—Ä—Ą–ł–Ĺ–į, —á—ā–ĺ –∑–į—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –ľ–į–ļ—Ä–ĺ—Ü–ł–ļ–Ľ –Ņ—Ä–ł–Ĺ–ł–ľ–į—ā—Ć –Ī–ĺ–Ľ–Ķ–Ķ —Ā–ľ–ĺ—Ä—Č–Ķ–Ĺ–Ĺ—É—é —Ą–ĺ—Ä–ľ—É.
–ü—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į–Ķ–ľ—č–Ļ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ –ľ–Ķ—ā–į–Ĺ–ĺ–≥–Ķ–Ĺ–Ķ–∑–į
–ź–ļ—ā–ł–≤–Ĺ–į—Ź —Ą–ĺ—Ä–ľ–į F430 —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā Ni(I), –į–Ĺ–į–Ľ–ĺ–≥–ł—á–Ĺ–ĺ –≤–ĺ—Ā—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–Ĺ–ĺ–ľ—É –ļ–ĺ—Ą–į–ļ—ā–ĺ—Ä—É B12, —Ā–ĺ–ī–Ķ—Ä–∂–į—Č–Ķ–ľ—É Co(I). –ü—Ä–ł–Ĺ–ł–ľ–į—Ź –≤–ĺ –≤–Ĺ–ł–ľ–į–Ĺ–ł–Ķ, —á—ā–ĺ —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—č Co(I) –Ĺ–į—Ö–ĺ–ī—Ź—ā—Ā—Ź –≤ d8 –ł –Ņ–ĺ—ā–ĺ–ľ—É –ī–Ķ–ľ–į–≥–Ĺ–ł—ā–Ķ–Ĺ, —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—č Ni(I) –Ĺ–į—Ö–ĺ–ī—Ź—ā—Ā—Ź –≤ —Ā–ĺ—Ā—ā–ĺ—Ź–Ĺ–ł–ł d9 –ł –Ņ–į—Ä–į–ľ–į–≥–Ĺ–ł—ā–Ķ–Ĺ. –ú–Ķ—Ö–į–Ĺ–ł–∑–ľ —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ļ–ĺ—ā–ĺ—Ä–ĺ–ľ—É –Ņ—Ä–ł—Ä–ĺ–ī–į —Ä–į–∑—Ä—č–≤–į–Ķ—ā CH3-S —Ā–≤—Ź–∑—Ć –≤ –ľ–Ķ—ā–ł–Ľ–ļ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–Ķ M –ī–ĺ –ļ–ĺ–Ĺ—Ü–į –Ķ—Č—Ď –Ĺ–Ķ—Ź—Ā–Ķ–Ĺ, —Ö–ĺ—ā—Ź –ł –ł–∑–≤–Ķ—Ā—ā–Ĺ–ĺ, —á—ā–ĺ –ļ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā B –ł –ļ–ĺ—Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā M –ľ–ĺ–≥—É—ā –Ņ—Ä–ĺ–Ļ—ā–ł –≤ –ļ–į–Ĺ–į–Ľ –ĺ–ļ–į–Ĺ—á–ł–≤–į—é—Č–ł–Ļ—Ā—Ź –ĺ—Ā–Ķ–≤—č–ľ —Ā–į–Ļ—ā–ĺ–ľ –Ĺ–ł–ļ–Ķ–Ľ—Ź. –ü—Ä–į–≤–ī–ĺ–Ņ–ĺ–ī–ĺ–Ī–Ĺ—č–Ļ –ľ–Ķ—Ö–į–Ĺ–ł–∑–ľ –Ņ—Ä–Ķ–ī–Ņ–ĺ–Ľ–į–≥–į–Ķ—ā –Ņ–Ķ—Ä–Ķ–ī–į—á—É —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ĺ–≤ —Ā Ni(I) (—ā–į–ļ –ĺ–Ĺ —Ā—ā–į–Ĺ–ĺ–≤–ł—ā—Ā—Ź Ni(II)), –ł —ć—ā–ĺ—ā –Ņ–Ķ—Ä–Ķ–Ĺ–ĺ—Ā —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–ĺ–≤ –ł–Ĺ–ł—Ü–ł–ł—Ä—É–Ķ—ā —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ CH4. –í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ —Ā–ĺ–Ķ–ī–ł–Ĺ–Ķ–Ĺ–ł—Ź —Ä–į–ī–ł–ļ–į–Ľ–į –ľ–Ķ—ā–ł–Ľ-–ö–ĺ–ú —Ā HS –≥—Ä—É–Ņ–Ņ–ĺ–Ļ –ļ–ĺ—ć–Ĺ–∑–ł–ľ–į –≤—č—Ā–≤–ĺ–Ī–ĺ–∂–ī–į–Ķ—ā—Ā—Ź –Ņ—Ä–ĺ—ā–ĺ–Ĺ (H+) –ł –∑–į—Ö–≤–į—ā—č–≤–į–Ķ—ā –ĺ–ī–ł–Ĺ —ć–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ, –ĺ—ā–Ĺ–ł–ľ–į–Ķ—ā –Ķ–≥–ĺ —É Ni(II) –ł –≤–ĺ—Ā—Ā—ā–į–Ĺ–į–≤–Ľ–ł–≤–į—Ź Ni(I)[2].
–°—ā—Ä—É–ļ—ā—É—Ä–į F430 –Ī—č–Ľ–į –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–į –Ņ—Ä–ł –Ņ–ĺ–ľ–ĺ—Č–ł —Ä–Ķ–Ĺ—ā–≥–Ķ–Ĺ–ĺ–ļ—Ä–ł—Ā—ā–į–Ľ–Ľ–ĺ–≥—Ä–į—Ą–ł–ł –ł —Ź–ī–Ķ—Ä–Ĺ–ĺ –ľ–į–≥–Ĺ–ł—ā–Ĺ–ĺ-—Ä–Ķ–∑–ĺ–Ĺ–į–Ĺ—Ā–Ĺ–ĺ–Ļ —Ā–Ņ–Ķ–ļ—ā—Ä–ĺ–≥—Ä–į—Ą–ł–ł[3].
–Ď–Ķ—Ā–ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī–Ĺ–ĺ–Ķ –ĺ–ļ–ł—Ā–Ľ–Ķ–Ĺ–ł–Ķ –ľ–Ķ—ā–į–Ĺ–į
F430 –≤ –≤—č—Ā–ĺ–ļ–ł—Ö –ļ–ĺ–Ĺ—Ü–Ķ–Ĺ—ā—Ä–į—Ü–ł—Ź—Ö —Ā–ĺ–ī–Ķ—Ä–∂–ł—ā—Ā—Ź –≤ –Ī–į–ļ—ā–Ķ—Ä–ł—Ź—Ö, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –Ņ–ĺ-–≤–ł–ī–ł–ľ–ĺ–ľ—É –≤–ĺ–≤–Ľ–Ķ—á–Ķ–Ĺ—č –≤ –ĺ–Ī—Ä–į—ā–Ĺ—č–Ļ –ľ–Ķ—ā–į–Ĺ–ĺ–≥–Ķ–Ĺ–Ķ–∑, –≤–ĺ–≤—Ä–Ķ–ľ—Ź –ļ–ĺ—ā–ĺ—Ä–ĺ–≥–ĺ –ľ–Ķ—ā–į–Ĺ –Ņ—Ä–Ķ–≤—Ä–į—Č–į–Ķ—ā—Ā—Ź –≤ –ľ–Ķ—ā–ł–Ľ-–ö–ĺ–ú. –í –ĺ—Ä–≥–į–Ĺ–ł–∑–ľ–į—Ö –ļ–ĺ—ā–ĺ—Ä—č–Ķ –ĺ—Ā—É—Č–Ķ—Ā—ā–≤–Ľ—Ź—é—ā —ć—ā—É —É–ī–ł–≤–ł—ā–Ķ–Ľ—Ć–Ĺ—É—é —Ä–Ķ–į–ļ—Ü–ł—é –ī–ĺ 7 % –ł –≤–Ķ—Ā–į —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź–Ķ—ā –Ĺ–ł–ļ–Ķ–Ľ–Ķ–≤—č–Ļ –Ņ—Ä–ĺ—ā–Ķ–ł–Ĺ[4].
–ė—Ā—ā–ĺ—á–Ĺ–ł–ļ–ł
- ‚ÜĎ Thauer R.K. Biochemistry of Methanogenesis: a Tribute to Marjory Stephenson (–į–Ĺ–≥–Ľ.) // Microbiology : journal. ‚ÄĒ 1998. ‚ÄĒ Vol. 144, no. 9. ‚ÄĒ P. 2377‚ÄĒ2406. ‚ÄĒ doi:10.1099/00221287-144-9-2377. ‚ÄĒ PMID 9782487. –ź—Ä—Ö–ł–≤–ł—Ä–ĺ–≤–į–Ĺ–ĺ 17 –ľ–į—Ź 2020 –≥–ĺ–ī–į.
- ‚ÜĎ Finazzo C., Harmer J., Bauer C., et al. Coenzyme B induced coordination of coenzyme M via its thiol group to Ni(I) of F430 in active methyl-coenzyme M reductase (–į–Ĺ–≥–Ľ.) // J. Am. Chem. Soc.[–į–Ĺ–≥–Ľ.] : journal. ‚ÄĒ 2003. ‚ÄĒ April (vol. 125, no. 17). ‚ÄĒ P. 4988‚ÄĒ4989. ‚ÄĒ doi:10.1021/ja0344314. ‚ÄĒ PMID 12708843.
- ‚ÜĎ Farber G., Keller W.,Kratky C., Jaun B., Pfaltz A., Spinner C., Kobelt A., Eschenmoser A. Coenzyme F430 from Methanogenic Bacteria: Complete Assignment of Configuration Based on an X-ray Analysis of 12,13-diepi-F430 Pentamethyl Ester and n NMR Spectroscopy (–į–Ĺ–≥–Ľ.) // Helvetica Chimica Acta[–į–Ĺ–≥–Ľ.] : journal. ‚ÄĒ 1991. ‚ÄĒ Vol. 74. ‚ÄĒ P. 697‚ÄĒ716.
- ‚ÜĎ Kruger M., Meyerdierks A., Glockner F.O., et al. A conspicuous nickel protein in microbial mats that oxidize methane anaerobically (–į–Ĺ–≥–Ľ.) // Nature : journal. ‚ÄĒ 2003. ‚ÄĒ December (vol. 426, no. 6968). ‚ÄĒ P. 878‚ÄĒ881. ‚ÄĒ doi:10.1038/nature02207. ‚ÄĒ PMID 14685246.
|
|