![]() –ú–ĺ–ī–Ķ–Ľ –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł (1) –Ņ–ĺ–ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ĺ–į –≤–ĺ–ī–į
–ú–ĺ–ī–Ķ–Ľ –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł (1) –Ņ–ĺ–ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ĺ–į –≤–ĺ–ī–į
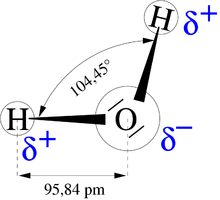 –Ē–ł–Ņ–ĺ–Ľ –≤–ĺ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į—ā–į –Ĺ–į –≤–ĺ–ī–į—ā–į.
–Ē–ł–Ņ–ĺ–Ľ –≤–ĺ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į—ā–į –Ĺ–į –≤–ĺ–ī–į—ā–į.
–í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į –Ķ –ľ–Ķ—ď—É–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ā–ļ–į –≤—Ä—Ā–ļ–į –ļ–ĺ—ė–į —Ā–Ķ —ė–į–≤—É–≤–į –Ņ–ĺ–ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ (–ł–Ľ–ł —ė–ĺ–Ĺ–ł—ā–Ķ) –≤–ĺ —ā–Ķ—á–Ĺ–ĺ—Ā—ā–ł—ā–Ķ –ł —Ü–≤—Ä—Ā—ā–ł—ā–Ķ —ā–Ķ–Ľ–į. –ě–≤–į–į –≤—Ä—Ā–ļ–į —Ā–Ķ–ļ–ĺ–≥–į—ą —Ā–Ķ —ė–į–≤—É–≤–į –ļ–į—ė –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –≤–ĺ –ļ–ĺ–ł –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł–ĺ—ā –į—ā–ĺ–ľ –Ķ —Ā–≤—Ä–∑–į–Ĺ –∑–į –ī—Ä—É–≥ –ľ–į–Ľ –į—ā–ĺ–ľ —Ā–ĺ –≥–ĺ–Ľ–Ķ–ľ–į –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ĺ—Ā—ā (–ļ–į–ļ–ĺ —Ą–Ľ—É–ĺ—Ä, –ļ–ł—Ā–Ľ–ĺ—Ä–ĺ–ī, –į–∑–ĺ—ā –ł –ī—Ä.) –ł –ī—Ä—É–≥ —ā–į–ļ–ĺ–≤ –į—ā–ĺ–ľ —ą—ā–ĺ —Ā–ĺ–ī—Ä–∂–ł –Ĺ–Ķ–Ņ–ĺ–ī–Ķ–Ľ–Ķ–Ĺ–ł –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—Ā–ļ–ł –Ņ–į—Ä–ĺ–≤–ł, –ĺ–ī –ī—Ä—É–≥, –ł–Ľ–ł, –Ņ–į–ļ, –ĺ–ī –ł—Ā—ā–į—ā–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į.
–ú–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ –≤–ĺ –ļ–ĺ–ł –≤–ĺ–ī–ĺ—Ä–ĺ–ī–ĺ—ā –Ķ —Ā–≤—Ä–∑–į–Ĺ –∑–į –į—ā–ĺ–ľ —Ā–ĺ –≥–ĺ–Ľ–Ķ–ľ–į –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ĺ—Ā—ā —Ā–Ķ –Ņ–ĺ–Ľ–į—Ä–Ĺ–ł, —Ā–ĺ –ī–Ķ–Ľ—É–ľ–Ĺ–ĺ –Ņ–ĺ–∑–ł—ā–ł–≤–Ķ–Ĺ –Ņ–ĺ–Ľ–Ĺ–Ķ–∂ (őī+) –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł–ĺ—ā –ł –ī–Ķ–Ľ—É–ľ–Ĺ–ĺ –Ĺ–Ķ–≥–į—ā–ł–≤–Ķ–Ĺ –Ņ–ĺ–Ľ–Ĺ–Ķ–∂ (őī-) –Ĺ–į –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ķ–≥–į—ā–ł–≤–Ĺ–ł–ĺ—ā –į—ā–ĺ–ľ. –ü–ĺ—Ä–į–ī–ł —ā–ĺ–į, –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł—ā–Ķ –į—ā–ĺ–ľ–ł —Ā—ā–į–Ņ—É–≤–į–į—ā –≤–ĺ –∑–į–Ķ–ľ–ĺ–ī–Ķ—ė—Ā—ā–≤–ł—ė–į —Ā–ĺ –Ĺ–Ķ–Ņ–ĺ–ī–Ķ–Ľ–Ķ–Ĺ–ł—ā–Ķ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ—Ā–ļ–ł –Ņ–į—Ä–ĺ–≤–ł –Ĺ–į –į—ā–ĺ–ľ–ĺ—ā –Ĺ–į –ī—Ä—É–≥ —ā–į–ļ–ĺ–≤ –Ķ–Ľ–Ķ–ļ—ā—Ä–ĺ–Ĺ–Ķ–≥–į—ā–ł–≤–Ķ–Ĺ –Ķ–Ľ–Ķ–ľ–Ķ–Ĺ—ā (–Ĺ–į—ė—á–Ķ—Ā—ā–ĺ –ĺ–ī –ī—Ä—É–≥–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į), –Ņ—Ä–ł —ą—ā–ĺ –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł–ĺ—ā –į—ā–ĺ–ľ —Ā–Ķ —ė–į–≤—É–≤–į –ļ–į–ļ–ĺ —Ā–≤–ĺ–Ķ–≤–ł–ī–Ķ–Ĺ "–ľ–ĺ—Ā—ā" –ľ–Ķ—ď—É —ā–ł–Ķ –ī–≤–į –į—ā–ĺ–ľ–į.
–°–≤–ĺ—ė—Ā—ā–≤–į –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į
–í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į –Ķ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ–Ĺ–ĺ –Ņ–ĺ—Ā–ł–Ľ–Ĺ–į –ĺ–ī –í–į–Ĺ –ī–Ķ—Ä –í–į–į–Ľ—Ā–ĺ–≤–ł—ā–Ķ –∑–į–Ķ–ľ–ĺ–ī–Ķ—ė—Ā—ā–≤–ł—ė–į, –Ĺ–ĺ, –Ĺ–į—ė—á–Ķ—Ā—ā–ĺ –Ķ –ī–ĺ—Ā—ā–į –Ņ–ĺ—Ā–Ľ–į–Ī–į –ĺ–ī –ļ–ĺ–≤–į–Ľ–Ķ–Ĺ—ā–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į. –°–Ķ–Ņ–į–ļ, —ā–į–į –ł–ľ–į —Ā–ł–Ľ–Ĺ–ĺ –≤–Ľ–ł—ė–į–Ĺ–ł–Ķ –≤—Ä–∑ —Ā–≤–ĺ—ė—Ā—ā–≤–į—ā–į –Ĺ–į —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł—ā–Ķ –ľ–Ķ—ď—É —á–ł–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ķ –Ņ—Ä–ł—Ā—É—ā–Ĺ–į. –Ę–ĺ–į, –Ņ—Ä–Ķ–ī —Ā√®, —Ā–Ķ –ī–ĺ–Ľ–∂–ł –Ĺ–į –į—Ā–ĺ—Ü–ł—Ä–į—ö–Ķ—ā–ĺ –Ĺ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ —ą—ā–ĺ —Ā–Ķ –Ņ–ĺ–≤—Ä–∑—É–≤–į–į—ā –ľ–Ķ—ď—É —Ā–Ķ–Ī–Ķ —Ā–ĺ –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į –≤—Ä—Ā–ļ–į –≤–ĺ –Ņ–ĺ–≥–ĺ–Ľ–Ķ–ľ–ł –į–≥—Ä–Ķ–≥–į—ā–ł. –Ę–ĺ–ļ–ľ—É –∑–į—ā–ĺ–į –≤–ĺ–ī–į—ā–į, –ļ–ĺ—ė–į –Ķ –ł–∑–≥—Ä–į–ī–Ķ–Ĺ–į –ĺ–ī –ľ–į–Ľ–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł, –ł–ľ–į —Ä–Ķ–Ľ–į—ā–ł–≤–Ĺ–ĺ –≤–ł—Ā–ĺ–ļ–į —ā–ĺ—á–ļ–į –Ĺ–į –≤—Ä–ł–Ķ—ö–Ķ. –ė–ľ–Ķ–Ĺ–ĺ, –Ņ–ĺ—ā—Ä–Ķ–Ī–Ĺ–ĺ –Ķ –Ĺ–į—ė–Ĺ–į–Ņ—Ä–Ķ–ī –ī–į —Ā–Ķ –ī–ĺ–≤–Ķ–ī–Ķ –ī–ĺ–Ņ–ĺ–Ľ–Ĺ–ł—ā–Ķ–Ľ–Ĺ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—ė–į –∑–į —Ä–į—Ā–ļ–ł–Ĺ—É–≤–į—ö–Ķ –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł—ā–Ķ –≤—Ä—Ā–ļ–ł –ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ, –į –Ņ–ĺ—ā–ĺ–į —ā–ł–Ķ –ī–į –ī–ĺ–Ī–ł—ė–į—ā –ī–ĺ–≤–ĺ–Ľ–Ĺ–ĺ –ļ–ł–Ĺ–Ķ—ā–ł—á–ļ–į –Ķ–Ĺ–Ķ—Ä–≥–ł—ė–į –∑–į –ī–į —ė–į –Ĺ–į–Ņ—É—ą—ā–į—ā —ā–Ķ—á–Ĺ–ĺ—Ā—ā–į. –°—É–Ņ—Ā—ā–į–Ĺ—Ü–ł—ā–Ķ –ł–∑–≥—Ä–į–ī–Ķ–Ĺ–ł –ĺ–ī –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –ļ–ĺ–ł –ľ–ĺ–∂–Ķ –ī–į –ĺ–Ī—Ä–į–∑—É–≤–į–į—ā –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł —Ā–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä–Ľ–ł–≤–ł –≤–ĺ –≤–ĺ–ī–į. –ü–ĺ–ļ—Ä–į—ė —ā–ĺ–į, –ļ–į—ė –ĺ–Ĺ–ł–Ķ —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł –ļ–į—ė –ļ–ĺ–ł –Ņ–ĺ—Ā—ā–ĺ–ł –ľ–ĺ–∂–Ĺ–ĺ—Ā—ā –∑–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ĺ —Ā–≤—Ä–∑—É–≤–į—ö–Ķ, —ā–ĺ—á–ļ–į—ā–į –Ĺ–į –≤—Ä–ł–Ķ—ö–Ķ –Ķ –Ņ–ĺ–≤–ł—Ā–ĺ–ļ–į –≤–ĺ –ĺ–ī–Ĺ–ĺ—Ā –Ĺ–į —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł —Ā–ĺ –Ņ—Ä–ł–Ī–Ľ–ł–∂–Ĺ–ł –≤—Ä–Ķ–ī–Ĺ–ĺ—Ā—ā–ł –∑–į –ľ–ĺ–Ľ–į—Ä–Ĺ–į—ā–į –ľ–į—Ā–į, –į –ļ–į—ė –ļ–ĺ–ł –Ĺ–Ķ–ľ–į –ľ–ĺ–∂–Ĺ–ĺ—Ā—ā –∑–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ĺ —Ā–≤—Ä–∑—É–≤–į—ö–Ķ.
–í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –ĺ–Ī—Ä–į–∑—É–≤–į –ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ĺ–į –Ķ–ī–Ĺ–į –ł—Ā—ā–į —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–į, –ļ–į–ļ–ĺ –ł –ľ–Ķ—ď—É –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –Ĺ–į —Ä–į–∑–Ľ–ł—á–Ĺ–ł —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł. –Ę–ĺ–ļ–ľ—É –∑–į—ā–ĺ–į –ĺ–Ĺ–ł–Ķ —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł –ļ–į—ė –ļ–ĺ–ł –Ņ–ĺ—Ā—ā–ĺ–ł –ľ–ĺ–∂–Ĺ–ĺ—Ā—ā –∑–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ĺ —Ā–≤—Ä–∑—É–≤–į—ö–Ķ —Ā–Ķ —Ä–į—Ā—ā–≤–ĺ—Ä–Ľ–ł–≤–ł –≤–ĺ –≤–ĺ–ī–į.
–ź–Ĺ–ĺ–ľ–į–Ľ–ł—ė–į –Ĺ–į –≤–ĺ–ī–į—ā–į
–†–į–∑–Ľ–ł–ļ–ł—ā–Ķ –≤–ĺ —ė–į—á–ł–Ĺ–į—ā–į –Ĺ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł—ā–Ķ –≤—Ä—Ā–ļ–ł –≤–ĺ —ā–Ķ—á–Ĺ–į—ā–į –≤–ĺ–ī–į –ł –≤–ĺ –ľ—Ä–į–∑–ĺ—ā —Ā–Ķ –Ņ—Ä–ł—á–ł–Ĺ–į –∑–į –į–Ĺ–ĺ–ľ–į–Ľ–ł—ė–į—ā–į –Ĺ–į –≤–ĺ–ī–į—ā–į. –Ę–Ķ—á–Ĺ–į—ā–į –≤–ĺ–ī–į –ł–ľ–į –Ņ–ĺ–≥–ĺ–Ľ–Ķ–ľ–į –≥—É—Ā—ā–ł–Ĺ–į –ĺ–ī –ľ—Ä–į–∑–ĺ—ā, –Ņ–ĺ—Ä–į–ī–ł —ą—ā–ĺ –ľ—Ä–į–∑–ĺ—ā –Ņ–Ľ–ł–≤–į –Ĺ–į –Ņ–ĺ–≤—Ä—ą–ł–Ĺ–į—ā–į –Ĺ–į –≤–ĺ–ī–į—ā–į. –ě–≤–į —Ā–Ķ –ī–ĺ–Ľ–∂–ł –Ĺ–į –Ņ–ĺ—Ā–Ľ–į–Ī–ł—ā–Ķ –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł –≤–ĺ –ľ—Ä–į–∑–ĺ—ā –≤–ĺ –ĺ–ī–Ĺ–ĺ—Ā –Ĺ–į —ā–Ķ—á–Ĺ–į—ā–į –≤–ĺ–ī–į, —ą—ā–ĺ –∑–Ĺ–į—á–ł –ī–Ķ–ļ–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł—ā–Ķ –≤–ĺ –ľ—Ä–į–∑–ĺ—ā —Ā–Ķ –Ĺ–į –Ņ–ĺ–≥–ĺ–Ľ–Ķ–ľ–ĺ –ľ–Ķ—ď—É—Ā–Ķ–Ī–Ĺ–ĺ —Ä–į—Ā—ā–ĺ—ė–į–Ĺ–ł–Ķ –ĺ—ā–ļ–ĺ–Ľ–ļ—É –≤–ĺ —ā–Ķ—á–Ĺ–į—ā–į –≤–ĺ–ī–į. –Ę–ĺ–į, –Ņ–į–ļ, –ĺ–ī –ī—Ä—É–≥–į —Ā—ā—Ä–į–Ĺ–į –∑–Ĺ–į—á–ł –ī–Ķ–ļ–į –ł—Ā—ā–į –ľ–į—Ā–į –ľ—Ä–į–∑ –≤–ĺ –ĺ–ī–Ĺ–ĺ—Ā –Ĺ–į —ā–Ķ—á–Ĺ–į—ā–į –≤–ĺ–ī–į —ú–Ķ –∑–į—Ą–į—ú–į –Ņ–ĺ–≥–ĺ–Ľ–Ķ–ľ –≤–ĺ–Ľ—É–ľ–Ķ–Ĺ, —ā.–Ķ. —ú–Ķ –ł–ľ–į –Ņ–ĺ–ľ–į–Ľ–į –≥—É—Ā—ā–ł–Ĺ–į.
–í–ł–ī–ĺ–≤–ł –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł
 –í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł –Ņ–ĺ–ľ–Ķ—ď—É –≥–≤–į–Ĺ–ł–Ĺ –ł —Ü–ł—ā–ĺ–∑–ł–Ĺ, –Ķ–ī–Ķ–Ĺ –ĺ–ī –ī–≤–į—ā–į –≤–ł–ī–į –Ĺ–į –Ī–į–∑–Ĺ–ł –Ņ–į—Ä–ĺ–≤–ł –≤–ĺ –Ē–Ě–ö.
–í–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł –Ņ–ĺ–ľ–Ķ—ď—É –≥–≤–į–Ĺ–ł–Ĺ –ł —Ü–ł—ā–ĺ–∑–ł–Ĺ, –Ķ–ī–Ķ–Ĺ –ĺ–ī –ī–≤–į—ā–į –≤–ł–ī–į –Ĺ–į –Ī–į–∑–Ĺ–ł –Ņ–į—Ä–ĺ–≤–ł –≤–ĺ –Ē–Ě–ö.
–°–Ķ–ļ–ĺ–≥–į—ą –ļ–ĺ–≥–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į —Ā–Ķ –ĺ–Ī—Ä–į–∑—É–≤–į –ľ–Ķ—ď—É –ī–≤–Ķ —Ä–į–∑–Ľ–ł—á–Ĺ–ł –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł, –Ī–ł–Ľ–ĺ –ī–į —Ā–Ķ –ĺ–ī –ł—Ā—ā–į –ł–Ľ–ł –ĺ–ī —Ä–į–∑–Ľ–ł—á–Ĺ–ł —Ā—É–Ņ—Ā—ā–į–Ĺ—Ü–ł, —Ā—ā–į–Ĺ—É–≤–į –∑–Ī–ĺ—Ä –∑–į —ā.–Ĺ.–ľ–Ķ—ď—É–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ā–ļ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į –≤—Ä—Ā–ļ–į. –ú–Ķ—ď—É—ā–ĺ–į, –Ņ–ĺ–Ĺ–Ķ–ļ–ĺ–≥–į—ą –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į—ā–į –≤—Ä—Ā–ļ–į –ľ–ĺ–∂–Ķ –ī–į —Ā–Ķ –ĺ–Ī—Ä–į–∑—É–≤–į –ł –ľ–Ķ—ď—É –į—ā–ĺ–ľ–ł—ā–Ķ –≤–ĺ –Ķ–ī–Ĺ–į –ł—Ā—ā–į –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į. –í–ĺ —ā–į–ļ–ĺ–≤ —Ā–Ľ—É—á–į—ė, —Ā—ā–į–Ĺ—É–≤–į –∑–Ī–ĺ—Ä –∑–į –≤–Ĺ–į—ā—Ä–Ķ–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ā–ļ–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–į –≤—Ä—Ā–ļ–į. –í–Ĺ–į—ā—Ä–Ķ–ľ–ĺ–Ľ–Ķ–ļ—É–Ľ—Ā–ļ–ł—ā–Ķ –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł –≤—Ä—Ā–ļ–ł –Ņ—Ä–ł–ī–ĺ–Ĺ–Ķ—Ā—É–≤–į–į—ā –∑–į —Ā—ā–į–Ī–ł–Ľ–Ĺ–ĺ—Ā—ā–į –Ĺ–į —ā–į–ļ–≤–ł—ā–Ķ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–ł –ł –∑–į –Ĺ–ł–≤–Ĺ–į—ā–į —Ā—ā—Ä—É–ļ—ā—É—Ä–į. –ě–ī —Ā–ł—ā–Ķ –≤–į–ļ–≤–ł –Ņ—Ä–ł–ľ–Ķ—Ä–ł, –Ĺ–į—ė–≤–į–∂–Ķ–Ĺ –Ķ –Ņ—Ä–ł–ľ–Ķ—Ä–ĺ—ā –∑–į –≤–ĺ–ī–ĺ—Ä–ĺ–ī–Ĺ–ł—ā–Ķ –≤—Ä—Ā–ļ–ł –≤–ĺ –Ī–Ķ–Ľ–ļ–ĺ–≤–ł–Ĺ–ł—ā–Ķ, –į –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–ĺ –≤–ĺ –ľ–ĺ–Ľ–Ķ–ļ—É–Ľ–į—ā–į –Ĺ–į –Ē–Ě–ö –ľ–Ķ—ď—É –Ņ–į—Ä–ĺ–≤–ł—ā–Ķ –Ĺ–į –Ī–į–∑–ł.