| Oxyhydroxyde de nickel(III)
|
|
|
| Identification |
| No CAS
|
5570-72-9
|
| PubChem
|
19695605
|
| Apparence
|
solide noir.
|
| Propriétés chimiques |
| Formule
|
HNiO2NiO(OH)
|
| Masse molaire[1]
|
91,700 1 ± 0,001 1 g/mol
H 1,1 %, Ni 64,01 %, O 34,9 %,
|
| Précautions |
| SGH |
  Danger H317 : Peut provoquer une allergie cutanée
H350i : Peut provoquer le cancer par inhalation.
H372 : Risque avéré d'effets graves pour les organes (indiquer tous les organes affectés, s'ils sont connus) à la suite d'expositions répétées ou d'une exposition prolongée (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
H413 : Peut entraîner des effets néfastes à long terme pour les organismes aquatiques
|
| Directive 67/548/EEC |
 T Numéro index : 028-005-00-3Symboles : T : ToxiquePhrases R : R43 : Peut entraîner une sensibilisation par contact avec la peau. R49 : Peut provoquer le cancer par inhalation. R53 : Peut entraîner des effets néfastes à long terme pour l’environnement aquatique. R48/23 : Toxique : risque d’effets graves pour la santé en cas d’exposition prolongée par inhalation.
|
|
| Unités du SI et CNTP, sauf indication contraire. |
modifier  |
L'oxyhydroxyde de nickel est un composé chimique minéral, corps ionique de formule chimique NiO(OH).
Propriétés physiques et chimiques
C'est un corps solide noir, insoluble dans la plupart des solvants mais attaqué par les bases fortes et les acides forts. Il s'agit d'un constituant important en électrochimie, en particulier un matériau commun des accumulateurs nickel-hydrure métallique ou des accumulateurs nickel-hydrogène.
Remarque sur la composition chimique, matériaux proches ou associés
Les oxydes de nickel(III) sont souvent mal caractérisés d'un point de vue de la composition chimique : rejoignant la catégorie des berthollides, ils apparaissent en composés non-stœchiométriques. L'oxyde de nickel(III) Ni2O3 n'a pas été confirmé par cristallographie. En ce qui concerne les applications en chimie organique, les oxydes de nickel ou les dérivés peroxydes sont la plupart du temps générés in situ et ses intermédiaires techniques d'oxydation souffrent d'un manque de caractérisation cristallographique. Par exemple, il a pu être prouvé que le "peroxyde de nickel" référencé CAS# 12035-36-8, est également étroitement apparenté, si ce n'est identique, à notre oxyhydroxyde NiO(OH)[2].
Structure cristallographique
Sa structure cristalline en couches est très similaire à celle du minéral brucite, polymorphe de l'hydroxyde de nickel(II), mais avec moitié moins en nombre d'atomes d'hydrogène. L'état d'oxydation du nickel est +3[3].
Préparation
Il peut être préparé par l'action du nitrate de nickel(II) sur une solution aqueuse d'hydroxyde de potassium, avec l'emploi de dibrome comme oxydant[4] :
- Ni(OH)2 + KOH + 1/2 Br2 → KBr + H2O + 2 NiOOH
Utilisation en chimie organique
Les oxydes de nickel(III) sont des catalyseurs d'oxydation générés in situ, par exemple pour l'oxydation de l'alcool benzylique en acide benzoïque dans un milieu aqueux à base d'eau de javel[5] :
![]()
De même, ce composé généré in situ catalyse la double oxydation de l'acide 3-butenoique en acide fumarique :
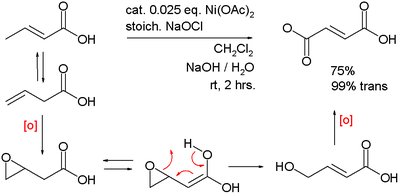
Références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ Gary W. Morrow, article "Nickel(II) Peroxide" in Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons. DOI 10.1002/047084289X.rn017
- ↑ M. Casas-Cabanas, J. Canales-Vazquez, J. Rodriguez Carvajal, M. R. Palacin, "Characterizing nickel battery materials: crystal structure of β-(NiOOH)" Materials Research Society Symposia Proceedings , 2009, § 1126, pp 131-136.
- ↑ O. Glemser "β-Nickel(III) Hydroxide" in Handbook of Preparative Inorganic Chemistry, 2nd édition, édité par G. Brauer, Academic Press, 1963, New-York, Volume1, p. 1549.
- ↑ Joseph M. Grill, James W. Ogle, and Stephen A. Miller, "An Efficient and Practical System for the Catalytic Oxidation of Alcohols, Aldehydes, and Unsaturated Carboxylic Acids", Journal of Organic Chemistry
|
|---|
| Ni(0) |
|
| Ni(II) |
|
| Ni(III) |
|
| Ni(IV) |
|