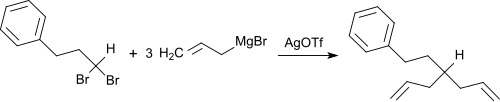
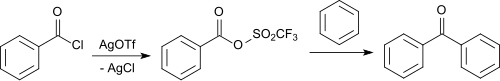
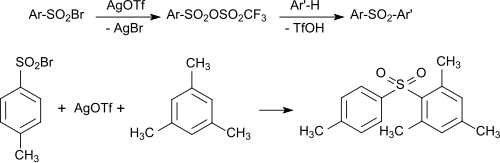
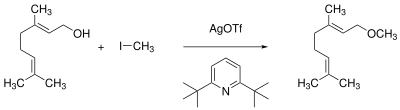
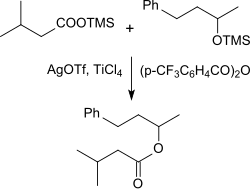
Silbertrifluormethansulfonat
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Armoiries de Kourou Détails Timbre Couronne murale. Écu De sable à la bande d'argent chargée d'un toucan au naturel sans œil ni patte, accompagnée à dextre d'un bagnard de carnation portant une pepite d'or sur sa coiffe de gueules et à senestre d'une fleur de lys d'or surmontée de deux serpents lovés et affrontés du même, au chef d'argent chargé de l'inscription KOUROU en lettres capitales de sable, abaissé sous un chef aussi de sable. Devise Courroux passe, tout malheur finit q...

?Kryptopterus cryptopterus Охоронний статус Найменший ризик (МСОП 3.1) Біологічна класифікація Домен: Ядерні (Eukaryota) Царство: Тварини (Animalia) Підцарство: Справжні багатоклітинні (Eumetazoa) Тип: Хордові (Chordata) Підтип: Черепні (Craniata) Надклас: Щелепні (Gnathostomata) Клас: Променепері (Act...

هذه المقالة يتيمة إذ تصل إليها مقالات أخرى قليلة جدًا. فضلًا، ساعد بإضافة وصلة إليها في مقالات متعلقة بها. (أبريل 2019) جوشوا كوهن معلومات شخصية الميلاد سنة 1951 (العمر 71–72 سنة) مواطنة الولايات المتحدة الحياة العملية المدرسة الأم جامعة هارفاردجامعة ييل المهنة ف�...

Begonia aconitifolia TaksonomiDivisiTracheophytaSubdivisiSpermatophytesKladAngiospermaeKladmesangiospermsKladeudicotsKladcore eudicotsKladSuperrosidaeKladrosidsKladfabidsOrdoCucurbitalesFamiliBegoniaceaeGenusBegoniaSpesiesBegonia aconitifolia A.DC., 1859 lbs Begonia aconitifolia adalah spesies tumbuhan yang tergolong ke dalam famili Begoniaceae. Spesies ini juga merupakan bagian dari ordo Cucurbitales. Nama ilmiah spesies ini pertama kali diterbitkan oleh Alphonse Pyramus de Candolle pada 185...

Призрен герб прапор Основні дані 42°13′48″ пн. ш. 20°44′24″ сх. д. / 42.23000000002777199° пн. ш. 20.74000000002777711° сх. д. / 42.23000000002777199; 20.74000000002777711Координати: 42°13′48″ пн. ш. 20°44′24″ сх. д. / 42.23000000002777199° пн. ш. 20.74000000002777711° сх. д. / 42.2...

CaraguatatubaMicrorregião de Caraguatatuba— Tiểu vùng — CaraguatatubaLocation in BrazilQuốc gia BrazilBangSão PauloThủ phủCaraguatatubaDiện tích • Tổng cộng1.948 km2 (752 mi2)Dân số (2007) • Tổng cộng223.914 • Mật độ110/km2 (300/mi2)Múi giờBRT (UTC-3) Caraguatatuba là một tiểu vùng thuộc bang São Paulo, Brasil. Tiều vùng này có diện tích 19...

سام شبيغل معلومات شخصية الميلاد 11 نوفمبر 1901 الوفاة 31 ديسمبر 1985 (84 سنة) [1] سانت مارتن مواطنة الولايات المتحدة النمسا الحياة العملية المدرسة الأم جامعة فيينا المهنة منتج أفلام اللغات الإنجليزية أعمال بارزة لورنس العرب، وجسر على نهر كواي، ...

Собор Святого Патрикаангл. St Patrick's Cathedral, Melbourne Собор Сент-Патрік (святого Патріка) у Мельбурні 37°48′36″ пд. ш. 144°58′34″ сх. д. / 37.81000° пд. ш. 144.97611° сх. д. / -37.81000; 144.97611Координати: 37°48′36″ пд. ш. 144°58′34″ сх. д. / 37.81000° пд. ш. 14...

Keuskupan Saint-Louis du SénégalDioecesis Sancti Ludovici SenegalensisPeta Keuskupan Saint-Louis du SénégalLokasiNegaraSenegalMetropolitDakarStatistikLuas73.315 km2 (28.307 sq mi)Populasi- Total- Katolik(per 2004)1.578.8534,850 (0.3%)InformasiRitusRitus LatinKepemimpinan kiniPausFransiskusUskupErnest Sambou Keuskupan Saint-Louis du Sénégal (bahasa Latin: Sancti Ludovici Senegalen(sis)) adalah sebuah keuskupan yang terletak di kota Saint-Louis, prov...

Cehu Silvaniei SzilágycsehKotaGereja Reformasi, Cehu SilvanieiNegara RumaniaCountyCounty SălajStatusKotaPemerintahan • Wali kotaAndrás Varga (UDMR)Luas • Total67,77 km2 (26,17 sq mi)Populasi (2011) • Total7.130Zona waktuUTC+2 (EET) • Musim panas (DST)UTC+3 (EEST)Situs webhttp://www.primaria-cehusilvaniei.ro Populasi historis Tahun JumlahPend. ±% 1977 8.302— 1992 8.954+...

Peta kronologi keanggotaan negara-negara NATO Perluasan Pakta Pertahanan Atlantik Utara (North Atlantic Treaty Organization, NATO) adalah proses memasukkan negara-negara anggota baru dalam NATO. NATO adalah aliansi militer dua puluh delapan negara Eropa dan dua negara Amerika Utara yang menganut sistem pertahanan kolektif. Proses penggabungan dengan aliansi tersebut diatur dalam Pasal 10 Traktat Atlantik Utara, yang hanya diijinkan melalui undangan negara-negara Eropa lainnya, dan melalui per...

Governor of Illinois from 1842 to 1846 Thomas Ford8th Governor of IllinoisIn officeDecember 8, 1842 – December 9, 1846LieutenantJohn MoorePreceded byThomas CarlinSucceeded byAugustus C. French Personal detailsBorn(1800-12-05)December 5, 1800Uniontown, Pennsylvania, USDiedNovember 3, 1850(1850-11-03) (aged 49)Peoria, Illinois, USPolitical partyDemocraticSpouse Frances Hambaugh (m. 1828)ProfessionLawyer, judgeSignature Thomas Ford (December 5, ...

Ethnic Kashmiris who practice Islam and are native to the Kashmir Valley Kashmiri MuslimsLanguagesKashmiri, UrduReligionIslam (Sunni majority) (Shia minority)Related ethnic groupsKashmiris, Kashmiri Hindus Kashmiri Muslims are ethnic Kashmiris who practice Islam and are native to the Kashmir Valley in Indian-administered Kashmir.[1][2] The majority of Kashmiri Muslims are Sunni.[3] They refer to themselves as Koshur in their mother language.[4][5][6...

Nyungic(reduced)GeographicdistributionSouth West (Western Australia)Linguistic classificationPama–NyunganSouthwestNyungicSubdivisions Nyungar Galaagu ?Kalaamaya GlottologNoneNyungic languages (green) among other Pama–Nyungan (tan). Classification of Bowern (2011). Nyungar is the section in the southwest. The Nyungic languages are the south-westernmost of the Australian Aboriginal languages:[1] Nyungar languages Galaagu language (Kalarko, Malpa) Kalaamaya–Natingero Galaagu and Ka...

Prince of Singha Vudhijaya ChalermlabhaวุฒิชัยเฉลิมลาภPrince of SinghaHRH Prince of SinghaMinister of DefenceIn office8 November 1931 – 19 June 1932PredecessorBoworadejSuccessorPhraya RatchawangsanaMinister of the Royal Siamese NavyIn office13 February 1924 – 30 June 1932PredecessorAsdang Dejavudh as the naval regentSuccessorPhraya Preechacholayudha as the commander-in-chiefBorn5 December 1883Bangkok, SiamDied18 October 1947 (aged 64)Bangkok, SiamS...

Type of dragon described in various mythologies This article is about sea serpents in mythology. For actual marine snakes, see Sea snake. For other uses, see Sea serpent (disambiguation). This article has multiple issues. Please help improve it or discuss these issues on the talk page. (Learn how and when to remove these template messages) This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may ...

Tomomi Itano板野 友美Tomomi Itano at the J-POP Summit Festival 2014 press conference in San Francisco, USABorn (1991-07-03) July 3, 1991 (age 32)[1]Yokohama, Kanagawa Prefecture[1]Other namesTomochin (ともちん)[2]Occupations Japanese idol singer songwriter dancer actress model Years active2005–presentChildren1FamilyNarumi Itano (younger sister) Keiji Takahashi (husband) (m. 2021)Musical careerGenresJ-popR&...

اتفاقية الشعوب الأصلية والقبلية 1989، هي معاهدة لمنظمة العمل الدولية (ILO) أو المعاهدة رقم (169). وهي من أهم الاتفاقيات الدولية الملزمة بشأن الشعوب الأصلية والقبلية والسباقة إلى إعلان حقوق الشعوب الأصلية. أُقرّت عام 1989 وتنصّ مقدمتها على:وإذ نضع في اعتبارنا المعايير الدولية الوا...

情報収集衛星(じょうほうしゅうしゅうえいせい、英語: Information Gathering Satellite, IGS)とは、日本の内閣官房が、安全保障や大規模災害への対応、その他の内閣の重要政策に関する画像情報収集を行うために運用している偵察衛星である[1]。 H-IIA 12号機によるIGSレーダ2号機の打ち上げ 導入の経緯 テポドンの発射 詳細は「北朝鮮によるミサイル発射実験 (1998年)�...

Азербайджанский язык Распространение азербайджанского языка: регионы, где он является языком большинства регионы, где он является языком значительного меньшинства Самоназвание Azərbaycan dili آذربایجان تۆرکجهسی Азәрбајҹан дили Страны Иран, Азербайджан, Россия, Груз...



![Synthese von Bicyclo[4.2.0]octan](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7a/Synthese_von_Bicyclo%284.2.0%29octan.svg/400px-Synthese_von_Bicyclo%284.2.0%29octan.svg.png)