|
Molibdè
| Molibdè
|
42Mo
|
|
|
| Aspecte
|
Gris metàl·lic

Fragment de molibdè cristal·lí i un cub d'1 cm³

Línies espectrals del molibdè
|
| Propietats generals
|
| Nom, símbol, nombre
|
Molibdè, Mo, 42
|
| Categoria d'elements
|
Metalls de transició
|
| Grup, període, bloc
|
6, 5, d
|
| Pes atòmic estàndard
|
95,96(2)
|
| Configuració electrònica
|
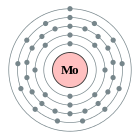
[Kr] 5s1 4d5
2, 8, 18, 13, 1
|
| Propietats físiques
|
| Fase
|
Sòlid
|
Densitat
(prop de la t. a.)
|
10,28 g·cm−3
|
Densitat del
líquid en el p. f.
|
9,33 g·cm−3
|
| Punt de fusió
|
2.896 K, 2.623 °C
|
| Punt d'ebullició
|
4.912 K, 4.639 °C
|
| Entalpia de fusió
|
37,48 kJ·mol−1
|
| Entalpia de vaporització
|
598 kJ·mol−1
|
| Capacitat calorífica molar
|
24,06 J·mol−1·K−1
|
| Pressió de vapor
|
| P (Pa)
|
1
|
10
|
100
|
1 k
|
10 k
|
100 k
|
| a T (K)
|
2.742
|
2.994
|
3.312
|
3.707
|
4.212
|
4.879
|
|
| Propietats atòmiques
|
| Estats d'oxidació
|
6, 5, 4, 3, 2, 1[1], -1, -2
(òxid àcid fort)
|
| Electronegativitat
|
2,16 (escala de Pauling)
|
| Energies d'ionització
|
1a: 684,3 kJ·mol−1
|
| 2a: 1.560 kJ·mol−1
|
| 3a: 2.618 kJ·mol−1
|
| Radi atòmic
|
139 pm
|
| Radi covalent
|
154±5 pm
|
| Miscel·lània
|
| Estructura cristal·lina
|
Cúbica centrada en el cos

|
| Ordenació magnètica
|
Paramagnètic[2]
|
| Resistivitat elèctrica
|
(20 °C) 53,4 nΩ·m
|
| Conductivitat tèrmica
|
138 W·m−1·K−1
|
| Difusivitat tèrmica
|
(300 K) 54,3[3] mm²/s
|
| Dilatació tèrmica
|
(25 °C) 4,8 µm·m−1·K−1
|
| Velocitat del so (barra prima)
|
(t. a.) 5.400 m·s−1
|
| Mòdul d'elasticitat
|
329 GPa
|
| Mòdul de cisallament
|
126 GPa
|
| Mòdul de compressibilitat
|
230 GPa
|
| Coeficient de Poisson
|
0,31
|
| Duresa de Mohs
|
5,5
|
| Duresa de Vickers
|
1.530 MPa
|
| Duresa de Brinell
|
1.500 MPa
|
| Nombre CAS
|
7439-98-7
|
| Isòtops més estables
|
| Article principal: Isòtops del molibdè
|
| Iso
|
AN
|
Semivida
|
MD
|
ED (MeV)
|
PD
|
| 92Mo
|
14,84%
|
92Mo és estable amb 50 neutrons
|
| 93Mo
|
sin
|
4×103 a
|
ε
|
-
|
93Nb
|
| 94Mo
|
9,25%
|
94Mo és estable amb 52 neutrons
|
| 95Mo
|
15,92%
|
95Mo és estable amb 53 neutrons
|
| 96Mo
|
16,68%
|
96Mo és estable amb 54 neutrons
|
| 97Mo
|
9,55%
|
97Mo és estable amb 55 neutrons
|
| 98Mo
|
24,13%
|
98Mo és estable amb 56 neutrons
|
| 99Mo
|
sin
|
65,94 h
|
β−
|
0,436
1,214
|
99mTc
|
| γ
|
0,74
0,36
0,14
|
-
|
| 100Mo
|
9,63%
|
7,8×1018 a
|
β−β−
|
3,04
|
100Ru
|
|
El molibdè[nota 1] o molibdé[nota 2] és l'element químic de símbol Mo i nombre atòmic 42. El seu nom deriva del mot neollatí molybdaenum, que al seu torn ve de la paraula grega antiga μόλυβδος ('mólibdos'), que significa 'plom', en referència al fet que els minerals de molibdè es confonien amb els de plom. Malgrat que els minerals de molibdè es coneixen des de temps immemorials, el primer a diferenciar aquest element de les sals minerals d'altres metalls fou Carl Wilhelm Scheele el 1778.[4] El primer a aïllar-lo fou Peter Jacob Hjelm el 1781.[5]
Es troba en el grup 6 de la taula periòdica dels elements.
El molibdè és un element essencial des del punt de vista biològic i s'utilitza sobretot en acers aliats.
Història
El molibdè no es troba lliure en la naturalesa i els compostos que es poden trobar van ser confosos amb altres compostos d'altres elements (carboni o plom) fins al segle xviii. El 1778 Carl Wilhelm Scheele va fer reaccionar el mineral molibdenita (MoS₂) amb àcid nítric obtenint un compost amb propietats àcides a què va anomenar acidum molibdenae (la paraula «molibdè» prové del grec mólibdos que vol dir 'com el plom', ja que era confós amb aquest element). El 1782 Hjelm va aïllar el metall impur per mitjà de la reducció de l'anterior compost amb carboni. El molibdè es va usar molt poc, i només dins del laboratori, fins a finals del segle xix, quan una empresa el va utilitzar com a agent aliant i va observar les bones propietats d'aquests aliatges amb molibdè.
El 2008, es va informar que l'escassetat de molibdè als oceans de la Terra primitiva era un factor limitant en l'evolució de la vida dels éssers eucariotes (que inclou totes les plantes i animals) com els eucariotes no poden fixar el nitrogen i ha d'adquirir dels bacteris procariotes.[6][7][8] L'escassetat de molibdè dona com a resultat la relativa falta d'oxigen a l'oceà primitiu. L'oxigen dissolt al mar ajuda a dissoldre els minerals de molibdè al fons del mar. Tot i això, encara que l'oxigen pot afavorir la fixació del nitrogen a través de la presa de molibdè disponible a l'aigua, també afecta els verins d'aquests enzims nitrogenases, per la qual cosa els organismes que segueix per fixar el nitrogen en condicions aeròbiques estan obligats a aïllar els seus enzims que fixen el nitrogen en heterocists, o estructures similars.
Obtenció
La principal font de molibdè és el mineral molibdenita (MS₂). També es pot trobar en altres minerals, com la wulfenita (PbMoO₄) i la powel·lita (CaMoO₄). El molibdè s'obté de la mineria dels seus minerals i com a subproducte de la mineria del coure; està present en les menes en un rang d'entre un 0,01 i un 0,5%. Aproximadament la meitat de la producció d'aquest element es localitza als Estats Units.
Existeix un tipus de minerals formats a partir d'òxids de molibdè anomenats molibdats, per exemple la Ferrimolibdita (Fe₂[MoO₄]₃).
Característiques principals
El molibdè és un metall de transició. El metall pur és de color blanc platejat i molt dur; a més, té un dels punts de fusió més alts d'entre tots els elements purs. En petites quantitats, s'empra en distints aliatges d'acer per a endurir-lo o fer-lo més resistent a la corrosió. D'altra banda, el molibdè és l'únic metall de la segona sèrie de transició al qual se li ha reconegut la seva essencialitat des del punt de vista biològic; es troba en alguns enzims amb distintes funcions, concretament en oxotransferases (funció de transferència d'electrons), com per exemple la xantina oxidasa, i en nitrogenases (funció de fixació de nitrogen molecular).[9] És un dels pocs metalls que resisteixen adequadament l'àcid clorhídric, sent el tàntal el més fort davant aquest medi corrosiu en específic. L'addició de quantitats mínimes del metall afecten la resistència a les solucions clorhídriques que normalment afecten els acers (fins i tot els inoxidables). De vegades amb un percentatge mínim de 2% de Mo en massa, els acers adquireixen la resistència necessària per operar en ambients marins. L'augment del molibdè als acers inoxidables augmenta la tenacitat i sobretot la resistència a l'atac dels compostos de clor.
En la seva forma pura, com a metall blanc platejat és el molibdè amb una duresa de Mohs de 5,5. Té un punt de fusió de 2623 °C. Dels elements naturals, només el tàntal, l'osmi, el reni, el tungstè i el carboni tenen punts de fusió més alts.[10] El molibdè només s'oxida ràpidament a temperatures superiors a 600 °C (una dèbil oxidació comença a 300 °C). El coeficient de dilatació és un dels més baixos entre els metalls utilitzats comercialment. La seva resistència a la tracció fa que els cables de molibdè augmentin de 10 a 30 GPa quan disminueix el diàmetre de 50-100 nm a 10 nm.[11]
Propietats químiques
El molibdè és un metall de transició amb una electronegativitat de 1,8 a l'escala de Pauling i una massa atòmica de 95,94 g/mol.[12] No reacciona amb oxigen o aigua a temperatura ambient. A temperatures elevades, es forma l'òxid de molibdè (VI): [13]
2 Mo + 3 O₂ → 2 MoO₃
El molibdè té diversos estats d'oxidació (vegeu la taula). Un exemple és la inestabilitat del molibdè (III) i del volframi (III) en comparació de l'estabilitat de crom (III). L'estat d'oxidació és més comú al molibdè (VI) (MoO₃) mentre que el compost d'òxid de sofre normal és el disulfur de molibdè (MoS₂).[14]
Estats d'oxidació
del molibdè.[15]
|
| −2 |
Na₂[Mo₂(CO)10]
|
| 0 |
Mo(CO)₆
|
| +1 |
Na[C₆H₆Mo]
|
| +2 |
MoCl₂
|
| +3 |
Na₃[Mo(CN)]₆
|
| +4 |
MoS₂
|
| +5 |
MoCl₅
|
| +6 |
MoF₆
| L'òxid de molibdè (VI) és soluble en bases i contribueix a la formació de molibdats (MoO₄2−). Els molibdats són menys oxidants que els cromats, però mostren una tendència similar quan formen oxoanions complexos per condensació en els valors de pH més baixos, com [Mo₇ O24 ]6- i [Mo₈ O26 ]4-. Els polimolibdats poden incorporar altres ions a la seva estructura, formant polioxometalats.[16] El fòsfor que conté heteropolimobdat P[Mo₁₂ O40 ]3− s'utilitza per a la detecció d'espectroscòpia al fòsfor.[17] L'àmplia gamma d'estats d'oxidació del molibdè es reflecteix en diversos clorurs de molibdè: [18]
- Clorur de molibdè (II) MoCl₂ (sòlid de color groc)
- Clorur de molibdè (III) MoCl₃ (sòlid de color vermell fosc)
- Clorur de molibdè (IV) MoCl₄ (sòlid de color negre)
- Clorur de molibdè (V) MoCl₅ (sòlid de color verd fosc)
- Clorur de molibdè (VI) MoCl₆ (sòlid de color marró)
L'estructura del MoCl₂ es compon de Mo₆ Cl₈4+ es compon de quatre ions de clorur que tendeixen a compensar la càrrega elèctrica.[19]
Com el crom i alguns altres metalls de transició, el molibdè és capaç de formar enllaços quàdruples, com a Mo₂ (CH₃ COO)₄. Aquest compost es pot transformar en Mo₂ Cl₈4− que també té un enllaç quàdruple.[20]
L'estat d'oxidació 0 és possible amb el monòxid de carboni com lligand, com en el molibdè hexacarbonil, Mo(CO)₆.[21]
Isòtops
El molibdè té sis isòtops estables i prop de dues dotzenes de radioisòtops, la major part amb períodes de semidesintegració de l'ordre de segons. El99Mo s'usa en els generadors de99Mo/99mTc per a la indústria d'isòtops nuclears.[22] S'estima que aquest mercat de productes de99Tc mou uns 100 milions d'euros a l'any.
Aplicacions
- Aproximadament dues terceres parts del molibdè consumit s'empren en aliatges. L'ús del molibdè es remunta a la Primera Guerra Mundial, quan va haver-hi una forta demanda de tungstè, que en va fer minvar les reserves, i es necessitaven acers molt resistents. El molibdè s'utilitza per a crear aliatges d'alta resistència, que suporten altes temperatures i la corrosió. Aquests aliatges s'usen en la construcció i en peces d'avions i automòbils.
- El molibdè s'usa com a catalitzador en la indústria petroliera, en concret, és útil per a l'eliminació del sofre.
- El99Mo s'empra en la indústria d'isòtops nuclears.
- S'empra en distints pigments (amb un color ataronjat), per a pintures, tints, plàstics i compostos de cautxú.
- El disulfur de molibdè (MoS₂) és un bon lubricant i es pot emprar a altes temperatures.
- El molibdè es pot també emprar en algunes aplicacions electròniques, com en les capes de metall conductores dels transistors TFT (Thin Film Transistor).
Rol biològic
És l'únic element de la segona sèrie de transició al qual se li ha reconegut la seva essencialitat. El molibdè es troba en la naturalesa en el rang de les parts per milió (ppm). Es troba en una quantitat important en l'aigua de mar en forma de molibdats (MoO₄2-), i els éssers vius poden absorbir-lo fàcilment en aquesta forma.
El molibdè es troba en l'anomenat cofactor de molibdè com en distintes oxotransferases, amb la funció de transferir àtoms d'oxigen de l'aigua (H₂O) al mateix temps que es produeix la transferència de dos electrons. Alguns dels enzims que contenen aquest cofactor són la xantina oxidasa que oxida la xantina en àcid úric, l'aldehid oxidasa que oxida aldehids, així com amines i sulfurs en el fetge, la sulfit oxidasa que oxida sulfits en el fetge, la nitrat reductasa, important en el cicle del nitrogen en les plantes, etcètera.
També es pot trobar un cofactor de ferro i molibdè en uns enzims anomenats nitrogenases. Aquestes nitrogenases intervenen en la fixació del nitrogen molecular atmosfèric dins del cicle del nitrogen en bacteris i altres microorganismes.
La deficiència de molibdè en l'organisme pot produir greus problemes, però es troba gairebé en tots els aliments i és difícil que s'arribi a donar el cas.
Bioquímica
El molibdè en els éssers vius és un heteroàtom de metall al lloc actiu en certs enzims. En la fixació de nitrogen en alguns bacteris,[23] l'enzim nitrogenasa participa en l'etapa terminal de la reducció de nitrogen molecular, en general conté molibdè al seu lloc actiu (encara que la substitució de Mo amb ferro o vanadi també és coneguda). L'estructura del centre catalític de l'enzim és similar a la de les proteïnes ferro-sofre, que incorpora 2 molècules (Fe₄ S₃ i MoFe₃ S₃).[24]
Els compostos de molibdè, tenen formes diverses molècules orgàniques (com carbohidrats i aminoàcids) i es transporta a través del cos humà com MoO₄ 2-.[25] Almenys 50 enzims que contenen molibdè són coneguts, principalment en els bacteris, i el seu nombre augmenta amb cada any;[26][27] els enzims inclouen l'aldehid oxidasa, sulfit oxidasa i la xantina oxidasa.[28] En alguns animals i en humans, es catalitza l'oxidació de la xantina a àcid úric, un procés de catabolisme de les purines, per la xantina oxidasa, un enzim que conté molibdè. L'activitat de la xantina oxidasa és directament proporcional a la quantitat de molibdè al cos. Tot i això, una alta concentració de molibdè s'inverteix la tendència i pot actuar com un inhibidor, tant en el catabolisme de les purines i altres processos. Les concentracions de molibdè també afecten la síntesi de proteïnes, el metabolisme i el procés de desenvolupament.[25]
En els animals i les plantes, aquests enzims usen el molibdè com un cofactor. Tots els éssers vius que utilitzen enzims de molibdè fins ara identificats en la naturalesa, usen aquest cofactor, excepte per la nitrogenasa, que fixa el nitrogen en alguns bacteris i cianobacteris.[29] Els enzims de molibdè a les plantes i animals catalitzen l'oxidació i la reducció de vegades de certes molècules petites, com a part de la regulació de nitrogen, sofre i els cicles del carboni.[30]
Humans amb deficiència alimentària
El cos humà conté al voltant de 0,07 mg de molibdè per quilogram de pes.[31] Es presenta en altes concentracions al fetge, als ronyons i a les vèrtebres.[32] El molibdè també és present a l'esmalt de les dents humanes i pot ajudar a prevenir el seu deteriorament. La carn de porc, la carn de xai i el fetge de res tenen cadascun al voltant d'1,5 ppm de molibdè.[32] Altres fonts alimentàries significatives són les mongetes tendres, ous, llavors de gira-sol, farina de blat, llenties i grans de cereals.[33]
La ingestió diària mitjana de molibdè varia entre 0,12 i 0,24 mg, però depèn del contingut de molibdè dels aliments.[34] La toxicitat aguda no s'ha vist en els éssers humans i depèn en gran manera de l'estat químic.[35][35] Encara que les dades de toxicitat humana no estan disponibles, els estudis en animals han demostrat que la ingesta crònica de més de 10 mg/dia de molibdè pot causar diarrea, retard en el creixement, infertilitat, i baix pes en néixer.[34] [36] També pot afectar els pulmons, els ronyons i el fetge. El tungstat sòdic és un inhibidor competitiu de molibdè, i la seva dieta redueix la concentració de molibdè en els teixits.[37]
La deficiència dietètica de molibdè des de la seva concentració sota la superfície terrestre s'ha associat amb majors taxes de càncer d'esòfag en parts de la Xina i l'Iran.[38][39] En comparació amb els Estats Units, que té una major oferta de molibdè a terra, les persones que viuen en aquestes àrees tenen un risc aproximadament 16 vegades més gran per al carcinoma esofàgic de cèl·lules escamoses.[40][41]
Malalties relacionades
Un cofactor de molibdè observat als lactants, acaba amb la capacitat del cos per a l'ús del molibdè als enzims. Fa que els alts nivells de sulfit i àcid úric, i el dany neurològic.[42][43] La causa és la incapacitat del cos per sintetitzar el cofactor de molibdè, una molècula que s'uneix amb cadenes heterocícliques de molibdè al lloc actiu de tots els enzims coneguts que utilitzen el molibdè.
Antagonisme del coure
Els alts nivells de molibdè poden interferir amb l'absorció de coure, produint deficiència de coure. El molibdè evita les proteïnes plasmàtiques d'unió al coure, i també augmenta la quantitat de coure que s'excreta a l'orina. Els remugants que consumeixen altes quantitats de molibdè presenten símptomes com diarrea, pèrdua de creixement, anèmia i achromotrichia (pèrdua del pigment del cabell). Aquests símptomes poden ser alleujats per l'administració de més coure al cos, tant en forma de dieta com per injecció.[44] La condició pot ser agreujada per l'excés de sofre.[45]
La reducció o la deficiència de coure també pot ser induïda deliberadament amb fins terapèutics pel compost d'amoni tetratiomolibdat, en què l'anió tetratiomolibdat brillant de color vermell és l'agent «quelant» de coure. El tetratiomolibdat va ser utilitzat per primera vegada en el tractament de la toxicosi de coure als animals. Va ser llavors quan es va introduir com un tractament en la malaltia de Wilson, un trastorn hereditari del metabolisme del coure en els éssers humans, que actua alhora competint amb l'absorció de coure a l'intestí i l'augment de l'excreció. També s'ha trobat per tenir un efecte inhibidor de l'angiogènesi, possiblement mitjançant la inhibició d'ions de coure, en el procés de translocació de membrana participant una via de secreció no clàssica.[46] Això fa que sigui un tractament interessant de recerca per al càncer, la degeneració macular associada a l'edat i altres malalties causen un dipòsit excessiu de molibdè als vasos sanguinis.[47][48]
Notes
Referències
- ↑ «Molybdenum: molybdenum(I) fluoride compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press.
- ↑ A. Lindemann, J. Blumm (2009). "Measurement of the Thermophysical Properties of Pure Molybdenum" a 17th Plansee Seminar. 3
- ↑ Gupta, C.K.. Extractive Metallurgy of Molybdenum. CRC Press, 2017, p. 2. ISBN 978-1-351-44900-7 [Consulta: 23 desembre 2021].
- ↑ Lepora, N. Molybdenum. Marshall Cavendish Benchmark, 2007, p. 11. ISBN 978-0-7614-2201-3 [Consulta: 23 desembre 2021].
- ↑ ; T. W., Lyons; A., Bekker; Y., Shen; S. W., Poulton «Tracing the stepwise oxygenation of the Proterozoic ocean». Nature, 452, 7186, 2008, pàg. 456–460. Bibcode: 2008Natur.452..456S. DOI: 10.1038/nature06811. PMID: 18368114.
- ↑ «International team of scientists discover clue to delay of life on Earth». Eurekalert.org. [Consulta: 25 octubre 2008].
- ↑ «Scientists uncover the source of an almost 2 billion year delay in animal evolution». Eurekalert.org. [Consulta: 25 octubre 2008].
- ↑ ; Dennis R., Dean; Dos Santos «A newly discovered role for iron-sulfur clusters». PNAS, 105, 33, 2008, pàg. 11589–11590. Bibcode: 2008PNAS..10511589D. DOI: 10.1073/pnas.0805713105. PMC: 2575256. PMID: 18697949.
- ↑ edited by Glenn D. Considine.. «Molybdenum». A: Van Nostrand's Encyclopedia of Chemistry, 2005, p. 1038–1040. ISBN 9780471615255.
- ↑ ; Kotrechko, Sergiy O; Mazilova, Tatjana I; Mikhailovskij, Igor M; Shpak «Inherent tensile strength of molybdenum nanocrystals» (free-download pdf). Science and Technology of Advanced Materials, 10, 2009, pàg. 045004. DOI: 10.1088/1468-6996/10/4/045004.
- ↑ «Properties of Molybdenum». Integral Scientist Periodic Table. Qivx, Inc., 2003. Arxivat de l'original el 12 de juny de 2007. [Consulta: 10 juny 2007].
- ↑ Winter, Mark. «Chemistry». Molybdenum. The University of Sheffield. [Consulta: 10 juny 2007].
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie. 91–100. Walter de Gruyter, 1985, p. 1096–1104. ISBN 3-11-007511-3.
- ↑ Schmidt, Max. «VI. Nebengruppe». A: Anorganische Chemie II. (en alemany). Wissenschaftsverlag, 1968, p. 119–127.
- ↑ ; Müller, Achim; Pope «Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines». Angewandte Chemie International Edition, 30, 1997, pàg. 34. DOI: 10.1002/anie.199100341.
- ↑ ed. by Nollet, Leo M.L.. Handbook of water analysis. New York, NY: Marcel Dekker, 2000, p. 280–288. ISBN 9780824784331.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie. 91–100. Walter de Gruyter, 1985, p. 1096–1104. ISBN 3-11-007511-3.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie. 91–100. Walter de Gruyter, 1985, p. 1096–1104. ISBN 3-11-007511-3.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie. 91–100. Walter de Gruyter, 1985, p. 1096–1104. ISBN 3-11-007511-3.
- ↑ Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie. 91–100. Walter de Gruyter, 1985, p. 1096–1104. ISBN 3-11-007511-3.
- ↑ Mesquita, A. Nuclear Reactors. IntechOpen, 2012, p. 324. ISBN 978-953-51-0018-8 [Consulta: 23 desembre 2021].
- ↑ Silva, Alinne da; Franzini, Vinícius I.; Piccolla, Cristiano D.; Muraoka, Takashi; Silva, Alinne da «Molybdenum supply and biological fixation of nitrogen by two Brazilian common bean cultivars». Revista Brasileira de Engenharia Agrícola e Ambiental, 21, 2, 01-02-2017, pàg. 100–105. DOI: 10.1590/1807-1929/agriambi.v21n2p100-105. ISSN: 1415-4366 [Consulta: 26 març 2017].
- ↑ ; Dennis R., Dean; Dos Santos «A newly discovered role for iron-sulfur clusters». PNAS, 105, 33, 2008, pàg. 11589–11590. Bibcode: 2008PNAS..10511589D. DOI: 10.1073/pnas.0805713105. PMC: 2575256. PMID: 18697949.
- ↑ 25,0 25,1 Mitchell, Phillip C. H. «Overview of Environment Database». International Molybdenum Association, 2003. Arxivat de l'original el 16 de maig de 2007. [Consulta: 5 maig 2007].
- ↑ Enemark, John H. et al. «Synthetic Analogues and Reaction Systems Relevant to the Molybdenum and Tungsten Oxotransferases». Chem. Rev., 104, 2, 2004, pàg. 1175–1200. DOI: 10.1021/cr020609d. PMID: 14871153.
- ↑ ; Bittner, Florian; Mendel «Cell biology of molybdenum». Biochimica et Biophysica Acta, 1763, 7, 2006, pàg. 621–635. DOI: 10.1016/j.bbamcr.2006.03.013. PMID: 16784786.
- ↑ Gupta, C. K.. Extractive Metallurgy of Molybdenum. CRC Press, 1992, p. 1–2. ISBN 9780849347580.
- ↑ [1] Arxivat 2021-11-10 a Wayback Machine. Structure, synthesis, empirical formula for the di-sulfhydryl. Accessed Nov. 16, 2009.
- ↑ ; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U «A structural comparison of molybdenum cofactor-containing enzymes» (en anglès). FEMS Microbiol. Rev., 22, 5, 1999, pàg. 503–521. DOI: 10.1111/j.1574-6976.1998.tb00384.x. PMID: 9990727.
- ↑ ; Wiberg; Holleman Inorganic chemistry. Academic Press, 2001, p. 1384. ISBN 0123526515.
- ↑ 32,0 32,1 edited by Glenn D. Considine.. «Molybdenum». A: Van Nostrand's Encyclopedia of Chemistry, 2005, p. 1038–1040. ISBN 9780471615255.
- ↑ Gupta, C. K.. Extractive Metallurgy of Molybdenum. CRC Press, 1992, p. 1–2. ISBN 9780849347580.
- ↑ 34,0 34,1 Coughlan, M. P. «The role of molybdenum in human biology». Journal of Inherited Metabolic Disease, 6, 1983, pàg. 70–77. DOI: 10.1007/BF01811327. PMID: 6312191.
- ↑ 35,0 35,1 «Risk Assessment Information System: Toxicity Summary for Molybdenum». Oak Ridge National Laboratory. Arxivat de l'original el 30 d'abril de 2008. [Consulta: 23 abril 2008].
- ↑ ; Barceloux, Donald; Barceloux «Molybdenum». Clinical Toxicology, 37, 2, 1999, pàg. 231–237. DOI: 10.1081/CLT-100102422. PMID: 10382558.
- ↑ edited by Glenn D. Considine.. «Molybdenum». A: Van Nostrand's Encyclopedia of Chemistry, 2005, p. 1038–1040. ISBN 9780471615255.
- ↑ Yang, Chung S. «Research on Esophageal Cancer in China: a Review». Cancer Research, 40, 1980, pàg. 2633.
- ↑ Nouri, Mohsen; Chalian, Hamid; Bahman, Atiyeh; Mollahajian, Hamid; Ahmadi-Faghih, Mohammadamin «Nail Molybdenum and Zinc Contents in Populations with Low and Moderate Incidence of Esophageal Cancer». Archives of Iranian Medicine, 11, 2008, pàg. 392. Arxivat de l'original el 2011-07-19 [Consulta: 10 novembre 2021]. Arxivat 2011-07-19 a Wayback Machine.
- ↑ «Molibdè».
- ↑ ; Bing, Li; Sanford M., Dawsey; Jun-Yao, Li; Chung S., Yang «Prevention of Esophageal Cancer: The Nutrition Intervention Trials in Linxian, China». Cancer Research, 54, 7 Suppl, 1994, pàg. 2029s–2031s. Arxivat de l'original el 2016-06-04. PMID: 8137333 [Consulta: 23 abril 2010].
- ↑ Smolinsky, B. et al. «Splice-specific Functions of Gephyrin in Molybdenum Cofactor Biosynthesis» (free text). Journal of Biological Chemistry, 283, 25, 2008, pàg. 17370. DOI: 10.1074/jbc.M800985200. PMID: 18411266.
- ↑ ; Reiss «Genetics of molybdenum cofactor deficiency». Human Genetics, 106, 2, 2000, pàg. 157. DOI: 10.1007/s004390051023. PMID: 10746556.
- ↑ Suttle, N. F. «Recent studies of the copper-molybdenum antagonism». Proceedings of the Nutrition Society. CABI Publishing, 33, 3, 1974, pàg. 299–305. DOI: 10.1079/PNS19740053. PMID: 4617883 [Consulta: 11 maig 2007].
- ↑ edited by Glenn D. Considine.. «Molybdenum». A: Van Nostrand's Encyclopedia of Chemistry. Nova York: Wiley-Interscience, 2005, p. 1038–1040. ISBN 9780471615255.
- ↑ Nickel, W «The Mystery of nonclassical protein secretion, a current view on cargo proteins and potential export routes». Eur. J. Biochem., 270, 2003, pàg. 2109–2119. DOI: 10.1046/j.1432-1033.2003.03577.x.
- ↑ Brewer GJ, Hedera P, Kluin KJ et al. «Treatment of Wilson disease with ammonium tetrathiomolybdate: III. Initial therapy in a total of 55 neurologically affected patients and follow-up with zinc therapy». Arch Neurol, 60, 3, 2003, pàg. 379–85. DOI: 10.1001/archneur.60.3.379. PMID: 12633149.
- ↑ A phase I trial of thiomolybdate as an chemotherapeutic agent in humans. Accessed Nov. 8 2009.
Vegeu també
Enllaços externs
Viccionari
|
|