Phل؛£n ل»©ng Diels-Alder (phل؛£n ل»©ng ؤگinxئ،-Anؤ‘ئ،) lأ phل؛£n ل»©ng hأ³a hل»چc trong hأ³a hل»چc hل»¯u cئ،, trong ؤ‘أ³ mل»™t anken (dienophile) phل؛£n ل»©ng vل»›i diene hل»‡ liأھn hل»£p, tل؛،o thأ nh dل؛«n xuل؛¥t cyclohexene. Otto Diels vأ Kurt Alder ؤ‘ئ°ل»£c trao giل؛£i thئ°ل»ںng Nobel vل»پ hأ³a hل»چc nؤƒm 1950 vأ¬ xأ¢y dل»±ng thأ nh cأ´ng phل؛£n ل»©ng nأ y [1][2][3][4].
.
Phل؛£n ل»©ng cل»™ng vأ²ng
Phل؛£n ل»©ng Diels-Alder lأ trئ°ل»ng hل»£p ؤ‘ل؛·c biل»‡t cل»§a loل؛،i phل؛£n ل»©ng tل»•ng quأ،t hئ،n: phل؛£n ل»©ng cل»™ng vأ²ng giل»¯a cأ،c hل»‡ د€. Trong phل؛£n ل»©ng Diels-Alder, 4 electron د€ cل»§a hل»‡ diene liأھn hل»£p phل؛£n ل»©ng vل»›i liأھn kل؛؟t ؤ‘أ´i cل»§a anken chل»©a 2 electron د€. Tأھn cل»§a phل؛£n ل»©ng nأ y lأ phل؛£n ل»©ng cل»™ng ؤ‘أ³ng vأ²ng [4 + 2][5] (cycloaddition [4 + 2])Viل»‡c thل»±c hiل»‡n cأ،c phل؛£n ل»©ng nأ y ؤ‘أ²i hل»ڈi phل؛§n lل»›n cل؛§n cung cل؛¥p nhiل»‡t.
Quy tل؛¯c Alder
Sل»± dل»… dأ ng cل»§a phل؛£n ل»©ng Diels-Alder phل»¥ thuل»™c mل؛،nh vأ o bل؛£n chل؛¥t cأ،c nhأ³m thل؛؟ cل»§a diene vأ dienophil. Phل؛£n ل»©ng nguyأھn mل؛«u dئ°ل»›i ؤ‘أ¢y, giل»¯a eten vأ buta-1,3-dien, rل؛¥t khأ³ vأ cho nؤƒng suل؛¥t tل؛،o cyclohexen tئ°ئ،ng ؤ‘ل»‘i thل؛¥p.
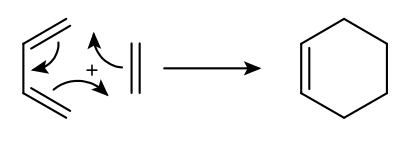 Phل؛£n ل»©ng Diels-Alder giل»¯a butadien vأ ethene.
Phل؛£n ل»©ng Diels-Alder giل»¯a butadien vأ ethene.
Quy tل؛¯c Alder: phل؛£n ل»©ng dل»… dأ ng thل»±c hiل»‡n hئ،n giل»¯a diene giأ u electron vأ dienophil nghأ¨o electron. Nأ³i cأ،ch khأ،c, mل»™t diene "tل»‘t" lأ ؤ‘ئ°ل»£c gل؛¯n thأھm cأ،c nguyأھn tل» hoل؛·c nhأ³m nguyأھn tل» ؤ‘ل؛©y electron vأ o hل»‡ liأھn hل»£p, mل»™t dienophile "tل»‘t" lأ ؤ‘ئ°ل»£c gل؛¯n thأھm cأ،c nguyأھn tل» hoل؛·c nhأ³m nguyأھn tل» hأ؛t electron tل»« nل»‘i ؤ‘أ´i.
Sل»± hأ؛t vأ ؤ‘ل؛©y election cل»§a cأ،c nhأ³m thل؛؟ phل»¥ thuل»™c vأ o cأ،c hiل»‡u ل»©ng cل»§a phل؛£n ل»©ng (hiل»‡u ل»©ng cل؛£m ل»©ng, liأھn hل»£p, siأھu liأھn hل»£p). Dئ°ل»›i ؤ‘أ¢y, phل؛£n ل»©ng giل»¯a 2,3-dimetylbuta-1,3-dien (cأ³ 2 nhأ³m methyl ؤ‘ل؛©y electron vأ o hل»‡ diene liأھn hل»£p) vأ propenal (nhأ³m aldehyd hأ؛t electron khل»ڈi nل»‘i ؤ‘أ´i) ؤ‘ئ°ل»£c thل»±c hiل»‡n vل»›i hiل»‡u suل؛¥t cao.
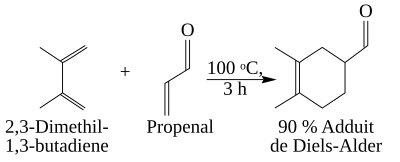 reaction2
reaction2
Cأ،c ankin ؤ‘ئ°ل»£c mأ nguyأھn tل» cacbon gل؛¯n vل»›i cأ،c nhأ³m thل؛؟ hأ؛t electron sل؛½ trل»ں thأ nh dienophil "tل»‘t" vأ lأ ؤ‘ل»‘i tئ°ل»£ng phل؛£n ل»©ng Diels - Alder. Thل؛t vل؛y, phل؛£n ل»©ng giل»¯a etin ؤ‘ئ°ل»£c gل؛¯n cأ،c nhأ³m thل؛؟ hأ؛t electron (vأ dل»¥ (CH3OOC)-Câ‰،C-(COOCH3)) vل»›i buta-1,3-diene lأ cأ³ thل»ƒ xل؛£y ra.
Hأ³a hل»چc lل؛p thل»ƒ cل»§a phل؛£n ل»©ng
Phل؛£n ل»©ng mل»ں rل»™ng vأ²ng [4+2] nأ y nل؛±m dئ°ل»›i sل»± kiل»ƒm soأ،t lل؛p thل»ƒ, dل؛«n ؤ‘ل؛؟n sل»± hأ¬nh thأ nh mل»™t ؤ‘ل»“ng phأ¢n endo. Sل»± chل»چn lل»چc nأ y thئ°ل»ng ؤ‘ئ°ل»£c chل»©ng minh bل؛±ng tأnh bل»پn cل»§a sل؛£n phل؛©m dل؛،ng ؤ‘ل»“ng phأ¢n endo
Phل؛£n ل»©ng cأ³ thل»ƒ ؤ‘ل؛£o ngئ°ل»£c. Cأ،c hل»£p chل؛¥t exo thئ°ل»ng ل»•n ؤ‘ل»‹nh nhل؛¥t vل»پ mل؛·t nhiل»‡t ؤ‘ل»™ng lل»±c hل»چc. Nل؛؟u phل؛£n ل»©ng ؤ‘ئ°ل»£c thل»±c hiل»‡n trong mل»™t thل»i gian rل؛¥t dأ i, thأ¬ trل؛،ng thأ،i cأ¢n bل؛±ng sل؛½ cأ³ lل»£i cho sل؛£n phل؛©m exo.
Phل؛£n ل»©ng ngئ°ل»£c
Phل؛£n ل»©ng ngئ°ل»£c, hay retro-Diels-Alder, ؤ‘ئ°ل»£c sل» dل»¥ng ؤ‘ل»ƒ ؤ‘iل»پu chل؛؟ cأ،c hل»£p chل؛¥t. Vأ dل»¥, cracking cyclohexene sل؛½ cho butadien vأ eten.
Thل»±c tiل»…n
Phل؛£n ل»©ng Diels-Alder gأ¢y ra nhiل»پu vل؛¥n ؤ‘ل»پ, cyclopentadiene lأ mل»™t vأ dل»¥. Trong quأ، trأ¬nh ؤ‘iل»پu chل؛؟ cyclopentadiene, thao tأ،c lأ m giل؛£m nhiل»‡t ؤ‘ل»™ ؤ‘ل؛؟n nhiل»‡t ؤ‘ل»™ phأ²ng sل؛½ hأ¬nh thأ nh hل»£p chل؛¥t ba vأ²ng. Hل»£p chل؛¥t thu ؤ‘ئ°ل»£c, ل»•n ؤ‘ل»‹nh ل»ں nhiل»‡t ؤ‘ل»™ phأ²ng (Teb=140آ°C), phل؛£i ؤ‘ئ°ل»£c chئ°ng cل؛¥t tل»« tل»« ؤ‘ل»ƒ thu hل»“i cyclopentadiene (Teb=41آ°C) nhل» phل؛£n ل»©ng retro-Diels-Alder.
Ghi chأ؛ vأ tأ i liل»‡u tham khل؛£o
- ^ Diels, O.; Alder, K. (1928). “Synthesen in der hydroaromatischen Reihe. I. Mitteilung: Anlagerungen von Di-en kohlenwasserstoffenâ€. Liebigs Ann. Chem (bل؛±ng tiل؛؟ng ؤگل»©c). 460 (1): 98–122. doi:10.1002/jlac.19284600106. ISSN 0075-4617.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. III. Mitteilung: Synthese von Terpenen, Camphern, hydroaromatischen und heterocyclischen Systemenâ€. Liebigs Ann. Chem (bل؛±ng tiل؛؟ng ؤگل»©c). 470 (1): 62–103. doi:10.1002/jlac.19294700106. ISSN 0075-4617.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. IV. Mitteilung: أœber die Anlagerung von Maleinsأ¤ure-anhydrid an arylierte Diene, Triene und Fulveneâ€. Ber. Dtsch. Chem. Ges. (bل؛±ng tiل؛؟ng ؤگل»©c). 62 (8): 2081–2087. doi:10.1002/cber.19290620829. ISSN 0365-947X.
- ^ Diels, O.; Alder, K. (1929). “Synthesen in der hydroaromatischen Reihe. V. Mitteilung: أœber خ”4-Tetrahydro-o-phthalsأ¤ureâ€. Ber. Dtsch. Chem. Ges. (bل؛±ng tiل؛؟ng ؤگل»©c). 62 (8): 2087–2090. doi:10.1002/cber.19290620830. ISSN 0365-947X.
- ^ “cycloaddition†(PDF).