 мЧЉк≥Љ мЮСмЭА лґДмЮРлКФ к≤Ф мЧђк≥Љ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉл°Ь лЛ®л∞±мІИ мЛЬл£МмЧРмДЬ м†Ьк±∞нХ† мИШ мЮИлЛ§. мєЉлЯЉмЧР м≤®к∞А лР† лХМ, мЮСмЭА лґДмЮРлКФ мИШмІА кµђмКђмЭШ кіСл≤ФмЬДнХЬ кЄ∞к≥µмЭД нЖµк≥ЉнХімХЉнХШмІАлІМ, лЛ®л∞±мІИ к∞ЩмЭА нБ∞ к±∞лМА лґДмЮРлКФ лУ§мЦі лІЮмІА мХКмХД м£Љл≥АмЭД мЧђнЦЙнХЬлЛ§. мЭіл†Зк≤МнХШл©і нБ∞ лґДмЮРк∞А мИШмІАл•Љ нЖµк≥ЉнХімХЉнХШлКФ мЮСмЭА лґДмЮРл≥ілЛ§ лє†л•Є мЖНлПДл°Ь мїђлЯЉмЭД нЖµк≥Љ нХ† мИШ мЮИлЛ§. лФ∞лЭЉмДЬ, нГИмЧЉ лРЬ лЛ®л∞±мІИмЭА лґДл¶ђлРШк≥† мИШмІС лР† мИШмЮИлЛ§.
мЧЉк≥Љ мЮСмЭА лґДмЮРлКФ к≤Ф мЧђк≥Љ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉл°Ь лЛ®л∞±мІИ мЛЬл£МмЧРмДЬ м†Ьк±∞нХ† мИШ мЮИлЛ§. мєЉлЯЉмЧР м≤®к∞А лР† лХМ, мЮСмЭА лґДмЮРлКФ мИШмІА кµђмКђмЭШ кіСл≤ФмЬДнХЬ кЄ∞к≥µмЭД нЖµк≥ЉнХімХЉнХШмІАлІМ, лЛ®л∞±мІИ к∞ЩмЭА нБ∞ к±∞лМА лґДмЮРлКФ лУ§мЦі лІЮмІА мХКмХД м£Љл≥АмЭД мЧђнЦЙнХЬлЛ§. мЭіл†Зк≤МнХШл©і нБ∞ лґДмЮРк∞А мИШмІАл•Љ нЖµк≥ЉнХімХЉнХШлКФ мЮСмЭА лґДмЮРл≥ілЛ§ лє†л•Є мЖНлПДл°Ь мїђлЯЉмЭД нЖµк≥Љ нХ† мИШ мЮИлЛ§. лФ∞лЭЉмДЬ, нГИмЧЉ лРЬ лЛ®л∞±мІИмЭА лґДл¶ђлРШк≥† мИШмІС лР† мИШмЮИлЛ§.
нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШ(Desalting and buffer exchange)мЭА мЪ©нХімД± к±∞лМА лґДмЮРл•Љ л≥ілЛ§ мЮСмЭА лґДмЮРмЧРмДЬ лґДл¶ђ(нГИмЧЉ)нХШк±∞лВШ мЭінЫДмЭШ мВђмЪ©мЧР м†БнХ©нХЬ мГБнГЬл°Ь мЩДмґ©мХ°мЭД кµРнЩШнХШлКФ л∞©л≤ХмЭілЛ§.[1] мЭілЯђнХЬ л∞©л≤ХмЭА к≤Ф мЧђк≥Љ нБђл°ЬлІИнЖ†кЈЄлЮШнФЉ мЫРл¶ђмЧР кЄ∞л∞ШнХШл©∞,[2] лґДмЮРм≤і нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ, нБђкЄ∞ л∞∞м†Ь нБђл°ЬлІИнЖ†кЈЄлЮШнФЉ(size-exclusion chromatography). нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШмЭА к∞АмЮ• мЭЉл∞Шм†БмЭЄ к≤Ф мЧђк≥Љ нБђл°ЬлІИнЖ†кЈЄлЮШнФЉмЭШ нЩЬмЪ©л≤Х м§С лСР к∞АмІАмЭіл©∞ лПЩмЭЉнХЬ л†ИмІДмЭД мВђмЪ©нХШмЧђ мИШнЦЙнХ† мИШ мЮИлЛ§.
нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШмЭА мЮСмЭА лЛ§к≥µмД± м§СнХ©м≤і лєДлУЬ (мИШмІА)л•Љ мВђм†Д нПЙнШХнЩФнХШкЄ∞ мЬДнХі мВђмЪ©лРШлКФ мЩДмґ©мХ°мЧРмДЬ мЛЬл£МмЭШ мД±лґДмЭД нЪМмИШнХШлКФ к≤ГмЭД мИШл∞ШнХЬлЛ§. нГИмЧЉмЭА лђЉк≥Љ кµРнЩШ нХ† лХМ мЩДмґ© мЧЉ л∞П лЛ§л•Є мЮСмЭА лґДмЮРк∞А мЛЬл£МмЧРмДЬ м†Ьк±∞ лР† лХМ л∞ЬмГЭнЮРлЛ§ (мИШмІАк∞А лђЉмЧРмДЬ мВђм†Д нПЙнШХ лР®). мЩДмґ©мХ° кµРнЩШмЭА мЛЬл£МмЭШ мЩДмґ©мХ°мЭД лЛ§л•Є мЩДмґ©мХ°мЭШ мЩДмґ©мХ°к≥Љ кµРнЩШ нХ† лХМ л∞ЬмГЭнХЬлЛ§.
мЭСмЪ©
нГИмЧЉмЭА лЛ®л∞±мІИ мЪ©мХ°, нОШлЖА лШРлКФ к≤∞нХ©лРШмІА мХКмЭА нХµмВ∞мЧРмДЬ лЙінБіл†ИмШ§нЛ∞лУЬ лШРлКФ к≥ЉлПДнХЬ к≤∞нХ© лШРлКФ м†СнХ©лРЬ лЛ®л∞±мІИмЭШ нСЬмІА мЛЬмХљмЬЉл°ЬлґАнД∞ мЧЉмЭД м†Ьк±∞нХШлКФлН∞ мВђмЪ©нХЬлЛ§. л≤ДнНЉ кµРнЩШмЭА лЛ®л∞±мІИ мЪ©мХ°мЭД мЭімШ® кµРнЩШ, м†ДкЄ∞ мШБлПЩ лШРлКФ мєЬнЩФмД± нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мЩА к∞ЩмЭА нЫДмЖН мЭСмЪ© мЛ§нЧШмЧР м†БнХ©нХЬ л≤ДнНЉ мЛЬмК§нЕЬмЬЉл°Ь м†ДлЛђнХШлКФлН∞ мВђмЪ©нХЬлЛ§.
нГИмЧЉ л∞П л≤ДнНЉ кµРнЩШмЭШ мЫРл¶ђ
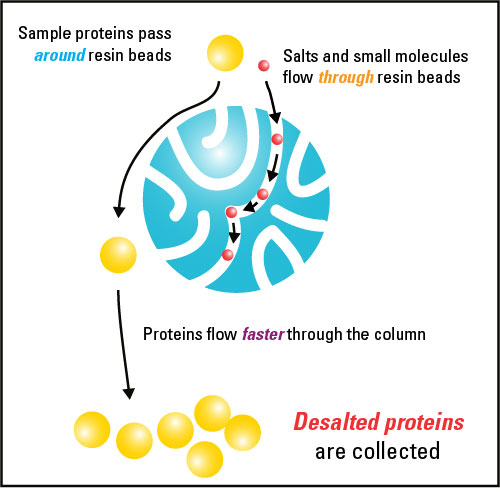
нБђкЄ∞л©імЧРмДЬ лѓЄлђШнХЬ м∞®мЭіл•Љ кЄ∞л∞ШмЬЉл°Ь к±∞лМА лґДмЮРл•Љ лґДл¶ђнХШкЄ∞мЬДнХЬ нБђкЄ∞ л∞∞м†Ь нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мЭСмЪ©л≤ХмЭА мЭЉл∞Шм†БмЬЉл°Ь кЄі нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мїђлЯЉмЧРмДЬ нБђк≥† лЛ§мЦСнХЬ кЄ∞к≥µ нБђкЄ∞л•Љ к∞ЦлКФ л†ИмІД(resin)мЭД мВђмЪ©нХЬлЛ§. кЈЄлЯђлВШ мЩДмґ©мХ° кµРнЩШ л∞П нГИмЧЉ мЪ©лПДмЭШ к≤љмЪ∞ лґДл¶ђ нХ† мИШ мЮИлКФ лґДмЮРмЭШ нБђкЄ∞л•Љ к≤∞м†ХнХШлКФ к≤ГмЭА м£Љл°Ь мµЬлМА мЬ†нЪ® к≥µкЈє нБђкЄ∞ (л∞∞м†Ь нХЬк≥Д лШРлКФ мИШмІАмЭШ лґДмЮРлЯЙ мїЈмШ§нФД (MWCO))мЭілЛ§. MWCOл≥ілЛ§ нБ∞ лґДмЮРлКФ мИШмІАмЭШ кЄ∞к≥µ мХИмЬЉл°Ь мє®нИђнХШмІАлІМ MWCOл≥ілЛ§ нБ∞ лґДмЮРлКФ кЄ∞к≥µмЧР лУ§мЦік∞АмДЬ кЄ∞лС•мЭШ лђінЪ® лґАнФЉмЧР нХ®кїШ лВ®мХДмЮИк≤МлРЬлЛ§. мГШнФМмЭД мґ©лґДнХЬ кЄЄмЭімЩА лґАнФЉмЭШ мїђлЯЉ мИШмІА л≤†лУЬл•Љ нЖµк≥ЉмЛЬнВімЬЉл°ЬмН®, к±∞лМА лґДмЮРлКФ л†ИмІД л≤†лУЬмЭШ кЄ∞к≥µмЭД нЖµнХі лНФ л©Ал¶ђ лЦ®мЦімІД мЮСмЭА лґДмЮРл°ЬлґАнД∞ мЩДм†ДнЮИ лґДл¶ђ лР† мИШ мЮИлЛ§. л∞∞м†Ь нХЬк≥Дл≥ілЛ§ нБ∞ лґДмЮРмЭШ нШДм†АнХЬ лґДл¶ђлКФ л∞ЬмГЭнХШмІА мХКлКФлЛ§.
мЫРнХШлКФ к±∞лМА лґДмЮРк∞А к≥µкЈє лґАнФЉ лВімЧР мЮФл•ШнХШкЄ∞ мЬДнХімДЬлКФ лІ§мЪ∞ мЮСмЭА к≥µкЈє нБђкЄ∞мЭШ мИШмІАл•Љ мВђмЪ©нХімХЉ нХЬлЛ§. м†ДнШХм†БмЭЄ нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШмЭШ к≤љмЪ∞ лґДмЮРлЯЙмЭі 5KDaмЩА 10KDa мВђмЭімЭЄ л†ИмІДмЭД мД†нГЭнХШлКФ к≤ГмЭі к∞АмЮ• мҐЛлЛ§. м†Дм≤і нБђкЄ∞(full-sized)мЭШ лЛ®л∞±мІИмЧРмДЬ нО©нЛ∞лУЬл•Љ лґДл¶ђнХШлКФ к≤Гк≥Љ к∞ЩмЭА лЛ§л•Є мЪ©лПДмЭШ к≤љмЪ∞, лНФ нБ∞ л∞∞м†Ь нХЬк≥Дк∞АмЮИлКФ л†ИмІДмЭі нХДмЪФнХ† мИШ мЮИлЛ§. к±∞лМА лґДмЮР мД±лґДмЭА к≤Ф мЧђк≥Љ кЄ∞мІИмЭД лѓЄл¶ђ нПЙнШХнЩФ мЛЬнВ§лКФлН∞ мВђмЪ©лРШлКФ мЩДмґ©мХ°мЧРмДЬ нЪМмИШлРШлКФ л∞Шл©і, мЖМлґДмЮРлКФ л≥ілЛ§ м†БмЭА лґДлЯЙмЭШ лґАнФЉл°Ь мИШмІСлРШк±∞лВШ л†ИмІДмЧР к∞ЗнЮИк≤МлРЬлЛ§. л†ИмІДмЭД мД†нГЭнХ† лХМ м£ЉмЭШнХімХЉ нХ† м§СмЪФнХЬ нКємІХ м§С нХШлВШлКФ м†Ьк±∞нХШк≥†мЮРнХШлКФ мЮСмЭА лґДмЮРк∞А м†Бм†ИнХЬ лґДл¶ђл•Љ мЬДнХі MWCOл≥ілЛ§ л™З л∞∞ мЮСмХДмХЉ нХЬлЛ§лКФ к≤ГмЭілЛ§.
нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШк≥Љ нИђмДЭмЭШ лєДкµР
нИђмДЭмЭА к≤Ф мЧђк≥Љ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉл°Ь мИШнЦЙлРШлКФ лПЩмЭЉнХЬ нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШ мЭСмЪ©мЧР мЬ†мЪ©нХШл©∞, лСР л∞©л≤Х л™®лСР мЬ†мВђнХЬ лґДмЮРлЯЙ м∞®лЛ® нХЬк≥ДмЧР кЈЉк±∞нХЬлЛ§. к≤Ф мЧђк≥ЉлКФ нИђмДЭмЧР лєДнХі мГБлМАм†БмЬЉл°Ь м†БмЭА мЦСмЭШ мЛЬл£МмЧРмДЬ мШ§мЧЉ лђЉмІИмЭД м†Ьк±∞нХ† мИШ мЮИлКФ лʕ놕к≥Љ нХ®кїШ мЬ†лПЕмД± лШРлКФ л∞©мВђмД± лђЉмІИл°Ь мЮСмЧЕ нХ† лХМ м§СмЪФнХЬ кЄ∞лК•мЭЄ мЖНлПДмЭШ мЭім†РмЭД к∞АмІАк≥† мЮИлЛ§(нИђмДЭмЭШ к≤љмЪ∞ л™З лґД лМА мЛЬк∞Д). л∞Шл©імЧР нИђмДЭмЭА мЮ•мєШ нШХмЛЭк≥Љ кіА놮нХШмЧђ нСЬл≥Є нБђкЄ∞мЧР нБђк≤М мЭШм°інХШмІА мХКлКФлЛ§. нИђмДЭ м†БмЪ©л≤ХмЭШ к≤љмЪ∞, лЖТмЭА лєДмЬ®мЭШ мГШнФМ нЪМмИШ л∞П лґДмЮР м†Ьк±∞л•Љ лЛђмД±нХШлКФ к≤ГмЭі к±∞мЭШ мµЬм†БнЩФлРШмІА мХКмЭА мГБнГЬмЧРмДЬ мЭЉл∞Шм†БмЬЉл°Ь к∞ДлЛ®нХШлЛ§. к≤Ф мЧђк≥Љ мЪ©лПДмЭШ к≤љмЪ∞ мЛЬл£МмЧР м†БнХ©нХЬ мїђлЯЉ нБђкЄ∞мЩА нШХмЛЭмЭД мД†нГЭнХШлКФ к≤ГмЭі м§СмЪФнХШлЛ§.
мЮСмЭА мЛЬл£М м≤Шл¶ђл•Љ мЬДнХЬ к≤Ф мЧђк≥Љ нШХмЛЭ
мЮСмЭА (4mL лѓЄлІМмЭШ) лґАнФЉмЧР лМАнХі к≤Ф мЧђк≥Љл•Љ мИШнЦЙнХШкЄ∞мЬДнХЬ мЧђлЯђ к∞АмІА мЭЉл∞Шм†БмЭЄ л∞©мЛЭмЭі мЮИлЛ§.
- нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мїђлЯЉ
- м§С놕 нЭРл¶Д мїђлЯЉ
- нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мєінКЄл¶ђмІА
- мїђлЯЉ мЫРмЛђ лґДл¶ђкЄ∞
- мЫРмЛђ лґДл¶ђкЄ∞ нФМл†ИмЭінКЄ
м§С놕 нЭРл¶Д, лШРлКФ лУЬл¶љл∞©мЛЭ, мєЉлЯЉмЭА л≤ДнНЉ м≤імЭімК§мЭШ лСРлґА мХХ놕мЭД мВђмЪ©нХШмЧђ мЛЬл£Мл•Љ к≤Ф мЧђк≥Љ лІ§нКЄл¶≠мК§мЧР л∞АмЦі лД£лКФлЛ§. мГШнФМмЭД мІБл¶љ кЄ∞лС•мЭШ мГБлЛ®мЧР лД£к≥† л†ИмІД л≤†лУЬл°Ь нЭШ놧 л≥ілВЄлЛ§. кЈЄлЯ∞ лЛ§мЭМ мГШнФМмЭД мїђлЯЉ мГБлЛ®мЧР мґФк∞А мЩДмґ©мХ° лШРлКФ лђЉмЭД мґФк∞АнХШмЧђ мїђлЯЉмЭД лФ∞лЭЉ мЂУмХДлВЄлЛ§. мЭі к≥Љм†ХмЧРмДЬ мЮСмЭА лґДнЪНмЭі мЭЉл∞Шм†БмЬЉл°Ь мИШмІСлРШк≥† к∞Бк∞БмЭШ кіАмЛђмЮИлКФ к±∞лМА лґДмЮРк∞А мЛЬнЧШлРЬлЛ§. к≤љмЪ∞мЧР лФ∞лЭЉ мЧђлЯђ лґДнЪНмЧР лЛ®л∞±мІИмЭі нПђнХ®лР† мИШ мЮИмЬЉл©∞ мИШмЬ®мЭД лЖТмЭікЄ∞ мЬДнХі нТАмЭД мВђмЪ©нХімХЉ нХ† мИШлПД мЮИлЛ§. лУЬл¶љ мїђлЯЉмЬЉл°Ь лґДл•ШлРЬ мЛЬк∞Д л∞П л™®лЛИнД∞лІБмЭД м†Ьк±∞нХШкЄ∞ мЬДнХі, мїђлЯЉмЭШ м†Дм≤і лђінЪ® лґАнФЉмЩА лПЩмЭЉнХЬ лґДмЬ®мЭі мГШнФМ мЪ©лЯЙмЧР кіАк≥ДмЧЖмЭі мИШмІСлРШмЦі мГШнФМмЭШ нШДм†АнХЬ нЭђмДЭмЭД міИлЮШнХЬлЛ§.
л∞АнПРлРЬ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мєінКЄл¶ђмІА лШРлКФ мїђлЯЉмЭА мХ°м≤і нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ (LC) мЛЬмК§нЕЬк≥Љ к∞ЩмЭА мЩЄлґА мЮ•мєШмЧР мЭШнХі мЛЬл£М л∞П мЩДмґ©мХ°мЭі мИШмІАл°Ь нОМнХСлРШлКФ к≤ГмЭД м†ЬмЩЄнХШк≥†лКФ мЬ†мВђнХШк≤М мЮСлПЩнХШл©∞ мЧђлЯђ лґДнЪНмЭШ мИШмІС л∞П л™®лЛИнД∞лІБмЭі нХДмЪФнХШлЛ§. мЭі л∞©л≤ХмЭА мҐЕмҐЕ л∞ШмЮРлПЩмЭікЄ∞лКФнХШмІАлІМ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мєінКЄл¶ђмІАл•Љ мВђмЪ©нХШлКФ к≤ГмЭА лМАк∞Ь нХЬ л≤ИмЧР нХЬ мГШнФМмЭД м≤Шл¶ђнХШлКФ к≤ГмЬЉл°Ь м†ЬнХЬлРШл©∞, м≤імЭімК§ л≤ДнНЉмЧРмДЬ мЭЉлґА мГШнФМ нЭђмДЭмЭі мЧђм†ДнЮИ л∞ЬмГЭнХ† мИШ мЮИлЛ§.
мЛЬл£М нЭђмДЭ л∞П лґДнЪНмЭШ мИШмІС л∞П л™®лЛИнД∞лІБмЭД м†Ьк±∞нХШкЄ∞ мЬДнХі мЫРмЛђ лґДл¶ђ мїђлЯЉ лШРлКФ нФМл†ИмЭінКЄ нГИмЧЉ (spin desalting)мЭілЭЉк≥†лПДнХШлКФ нФМл†ИмЭінКЄ кЄ∞л∞Ш к≤Ф мЧђк≥Љл≤ХмЭі мЭЉл∞Шм†БмЬЉл°Ь мВђмЪ©лРЬлЛ§. мК§нХА нГИмЧЉмЭА мЫРмЛђ лґДл¶ђкЄ∞л•Љ мВђмЪ©нХШмЧђ мИШмІАмЧРмДЬ мХ°м≤імЭШ к≥µкЈє м≤ім†БмЭД л®Љм†А м†Ьк±∞нХЬ лЛ§мЭМ мЛЬл£Мл•Љ м≤®к∞АнХШк≥† мЫРмЛђ лґДл¶ђнХШмЧђ мИШнЦЙнХЬлЛ§лКФ м†РмЧРмДЬ лПЕнКєнХШлЛ§лЛ§. мЫРмЛђ лґДл¶ђ нЫД мЛЬл£МмЭШ к±∞лМА лґДмЮРлКФ к±∞мЭШ лПЩмЭЉнХЬ міИкЄ∞ лґАнФЉл°Ь мїђлЯЉмЭД нЖµк≥ЉнХШмІАлІМ мЮСмЭА лґДмЮРлКФ л†ИмІДмЭШ кЄ∞к≥µмЬЉл°Ь лУ§мЦік∞Ак≥† к≤Ф мЧђк≥Љ лІ§нКЄл¶≠мК§л•Љ мВђм†Д нПЙнШХнЩФнХШлКФ лН∞ мВђмЪ©лРЬ мЩДмґ©мХ°мЬЉл°Ь кµРм≤ілРЬлЛ§. мК§нХА мїђлЯЉк≥Љ нФМл†ИмЭінКЄлКФ м§С놕 нЭРл¶ДмЧР мЭШнХі мЛЬл£Мк∞А мґЬнШД нХ† лХМкєМмІА кЄ∞лЛ§л¶і нХДмЪФк∞А мЧЖмЬЉлѓАл°Ь лЛ§м§С мЛЬл£М м≤Шл¶ђл•Љ лПЩмЛЬмЧР нЧИмЪ©нХШлКФ нБђл°ЬлІИнЖ† кЈЄлЮШнФЉ мЛЬмК§нЕЬмЭі нХДмЪФнХШмІА мХКлЛ§.
нГИмЧЉ л∞П мЩДмґ©мХ° кµРнЩШ мєЉлЯЉ л∞П нФМл†ИмЭінКЄ к≥µкЄЙ мЧЕм≤і
нГИмЧЉ мК§нХА мїђлЯЉмЭА лЛ§мЦСнХЬ лґАнФЉ л∞П MWCO нХЬлПД мХИмЧРмДЬ лДРл¶ђ мЭімЪ© к∞АлК•нХШлЛ§ :
мЩЄлґА мЮРмЫР
к∞Бм£Љ