![]() бғ°бғ”бғҡбғҳбғЈбғӣбғҳбғЎ бғҗбғўбғқбғӣбғҳбғЎ бғЎбғҘбғ”бғӣбғҗ, бғңбғҗбғ©бғ•бғ”бғңбғ”бғ‘бғҳбғҗ бғЎбғ”бғ бғҳ бғӨбғ”бғ бғҳбғ— бғ”бғҡбғ”бғҘбғўбғ бғқбғңбғЈбғҡбғҳ бғЎбғҳбғӣбғӯбғҳбғ“бғ бғқбғ•бғҳбғЎ бғҗбғҡбғ‘бғҗбғ—бғқбғ‘бғҗ
бғ°бғ”бғҡбғҳбғЈбғӣбғҳбғЎ бғҗбғўбғқбғӣбғҳбғЎ бғЎбғҘбғ”бғӣбғҗ, бғңбғҗбғ©бғ•бғ”бғңбғ”бғ‘бғҳбғҗ бғЎбғ”бғ бғҳ бғӨбғ”бғ бғҳбғ— бғ”бғҡбғ”бғҘбғўбғ бғқбғңбғЈбғҡбғҳ бғЎбғҳбғӣбғӯбғҳбғ“бғ бғқбғ•бғҳбғЎ бғҗбғҡбғ‘бғҗбғ—бғқбғ‘бғҗ
бғҗбғўбғқбғӣбғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғҳ бғ”бғ¬бғқбғ“бғ”бғ‘бғҗ бғӣбғҗбғңбғ«бғҳбғҡбғЎ бғҗбғӣ бғҗбғўбғқбғӣбғҳбғЎ бғ‘бғҳбғ бғ—бғ•бғЎбғҗ бғ“бғҗ бғ”бғҡбғ”бғҘбғўбғ бғқбғңбғЈбғҡбғҳ бғ’бғҗбғ бғЎбғҳбғЎ бғ§бғ•бғ”бғҡбғҗбғ–бғ” бғЁбғқбғ бғЎ бғӣбғ“бғ”бғ‘бғҗбғ бғ” бғ”бғҡбғ”бғҘбғўбғ бғҳбғңбғҳбғЎ бғЎбғўбғҗбғ‘бғҳбғҡбғЈбғ бғқбғ бғ‘бғҳбғўбғҗбғЎ бғЁбғқбғ бғҳбғЎ. бғҗбғ®бғҡбғҗ бғӣбғҳбғҰбғ”бғ‘бғЈбғҡбғҳбғҗ бғҗбғӣ бғһбғҗбғ бғҗбғӣбғ”бғўбғ бғҳбғЎ бғһбғҳбғҷбғқбғӣбғ”бғўбғ бғ”бғ‘бғЁбғҳ (1 pm = 10вҲ’12m) бғ’бғҗбғӣбғқбғЎбғҗбғ®бғ•бғҗ. бғҗбғ“бғ бғ” бғҗбғӣ бғӣбғҳбғ–бғңбғҳбғЎбғҗбғ—бғ•бғҳбғЎ бғҳбғ§бғ”бғңбғ”бғ‘бғ“бғңбғ”бғң бғҗбғңбғ’бғЎбғўбғ бғ”бғӣбғЎ (1 Г… = 10вҲ’10m).
бғҗбғўбғқбғӣбғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғҳбғЎ бғЁбғ”бғӨбғҗбғЎбғ”бғ‘бғҗ
бғҷбғ•бғҗбғңбғўбғЈбғ бғҳ бғӣбғ”бғҘбғҗбғңбғҳбғҷбғҳбғЎ бғӣбғҳбғ®бғ”бғ“бғ•бғҳбғ—, бғҗбғўбғқбғӣбғ”бғ‘бғЎ бғҗбғ бғ’бғҗбғҗбғ©бғңбғҳбғҗбғ— бғӣбғҷбғҗбғӨбғҳбғқ бғ–бғЈбғЎбғўбғҳ бғЎбғҗбғ–бғҰбғ•бғҗбғ бғ”бғ‘бғҳ, бғӣбғҗбғ’бғ бғҗбғӣ бғ”бғҡбғ”бғҘбғўбғ бғқбғңбғҳбғЎ бғһбғқбғ•бғңбғҳбғЎ бғЁбғ”бғЎбғҗбғ«бғҡбғ”бғ‘бғҡбғқбғ‘бғҗ бғ бғқбғӣбғ”бғҡбғҳбғӘ бғ“бғҗбғҷбғҗбғ•бғЁбғҳбғ бғ”бғ‘бғЈбғҡбғҳбғҗ бғҗбғӣ бғҗбғўбғқбғӣбғҳбғЎ бғ‘бғҳбғ бғ—бғ•бғ—бғҗбғң, бғӣбғҳбғЎбғ’бғҗбғң бғ’бғҗбғ бғҷбғ•бғ”бғЈбғҡ бғӣбғҗбғңбғ«бғҳбғҡбғ–бғ” бғӣбғҷбғ•бғ”бғ—бғ бғҗбғ“ бғӣбғӘбғҳбғ бғ“бғ”бғ‘бғҗ бғӣбғҗбғңбғ«бғҳбғҡбғҳбғЎ бғ’бғҗбғ–бғ бғ“бғҗбғЎбғ—бғҗбғң бғ”бғ бғ—бғҗбғ“. бғҗбғӣбғҳбғўбғқбғӣ бғҗбғўбғқбғӣбғЎ бғӣбғҳбғҗбғ¬бғ”бғ бғ”бғң бғ бғҗбғҰбғҗбғӘ бғ бғҗбғ“бғҳбғЈбғЎбғЎ, бғ бғқбғӣбғҡбғҳбғЎ бғЁбғҳбғ’бғңбғҳбғ—бғҗбғӘ бғӣбғқбғҳбғҗбғ–бғ бғ”бғ‘бғҗ бғ”бғҡбғ”бғҘбғўбғ бғқбғңбғЈбғҡбғҳ бғЎбғҳбғӣбғӯбғҳбғ“бғ бғқбғ•бғҳбғЎ бғЈбғ“бғҳбғ“бғ”бғЎбғҳ бғңбғҗбғ¬бғҳбғҡбғҳ (90%-бғ–бғ” бғӣбғ”бғўбғҳ).
бғҗбғўбғқбғӣбғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғҳ бғ“бғҗ бғ‘бғҳбғ бғ—бғ•бғ”бғ‘бғЎбғЁбғқбғ бғҳбғЎбғҳ бғӣбғҗбғңбғ«бғҳбғҡбғҳ
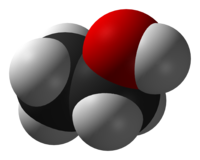 бғ”бғ—бғҗбғңбғқбғҡбғҳбғЎ бғӣбғқбғҡбғ”бғҷбғЈбғҡбғҗ, CH 3 CH 2 OH. бғ§бғқбғ•бғ”бғҡбғҳ бғҗбғўбғқбғӣбғҳ бғӣбғқбғ“бғ”бғҡбғҳбғ бғ”бғ‘бғЎ бғЎбғӨбғ”бғ бғқбғЁбғҳ бғ•бғҗбғң-бғ“бғ”бғ -бғ•бғҗбғҗбғҡбғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғҳбғЎ бғ”бғҡбғ”бғӣбғ”бғңбғўбғҳбғ—
бғ”бғ—бғҗбғңбғқбғҡбғҳбғЎ бғӣбғқбғҡбғ”бғҷбғЈбғҡбғҗ, CH 3 CH 2 OH. бғ§бғқбғ•бғ”бғҡбғҳ бғҗбғўбғқбғӣбғҳ бғӣбғқбғ“бғ”бғҡбғҳбғ бғ”бғ‘бғЎ бғЎбғӨбғ”бғ бғқбғЁбғҳ бғ•бғҗбғң-бғ“бғ”бғ -бғ•бғҗбғҗбғҡбғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғҳбғЎ бғ”бғҡбғ”бғӣбғ”бғңбғўбғҳбғ—
бғЈбғӣбғ”бғўбғ”бғЎ бғЁбғ”бғӣбғ—бғ®бғ•бғ”бғ•бғҗбғЁбғҳ бғқбғ бғҳ бғҗбғўбғқбғӣбғҳбғЎ бғ‘бғҳбғ бғ—бғ•бғ”бғ‘бғЎ бғЁбғқбғ бғҳбғЎ бғЈбғӣбғқбғҷбғҡбғ”бғЎбғҳ бғӣбғҗбғңбғ«бғҳбғҡбғҳ бғӣбғҗбғ бғ—бғҡбғҗбғӘ бғӣбғҳбғҗбғ®бғҡбғқбғ”бғ‘бғҳбғ— бғўбғқбғҡбғҳбғҗ бғҗбғӣ бғҗбғўбғқбғӣбғ”бғ‘бғҳбғЎ бғ бғҗбғ“бғҳбғЈбғЎбғ”бғ‘бғҳбғЎ бғҜбғҗбғӣбғЎ. бғҗбғўбғқбғӣбғ”бғ‘бғЎ бғЁбғқбғ бғҳбғЎ бғҷбғҗбғ•бғЁбғҳбғ бғ”бғ‘бғҳбғЎ бғўбғҳбғһбғҳбғЎ бғӣбғҳбғ®бғ”бғ“бғ•бғҳбғ— бғ’бғҗбғңбғҗбғЎбғ®бғ•бғҗбғ•бғ”бғ‘бғ”бғң бғҡбғҳбғ—бғқбғңбғЈбғ бғЎ (бғӣбғ”бғўбғҗбғҡбғЈбғ бғҳ), бғҳбғқбғңбғЈбғ бғЎ, бғҷбғқбғ•бғҗбғҡбғ”бғңбғўбғЈбғ бғ“бғҗ бғ–бғқбғ’ бғЎбғ®бғ•бғҗ бғҗбғўбғқбғӣбғЈбғ бғ бғҗбғ“бғҳбғЈбғЎбғ”бғ‘бғЎ.
бғҳбғ®бғҳбғҡбғ”бғ— бғҗбғ’бғ бғ”бғ—бғ•бғ”
бғ бғ”бғЎбғЈбғ бғЎбғ”бғ‘бғҳ бғҳбғңбғўбғ”бғ бғңбғ”бғўбғЁбғҳ
http://www.xumuk.ru/encyklopedia/406.html