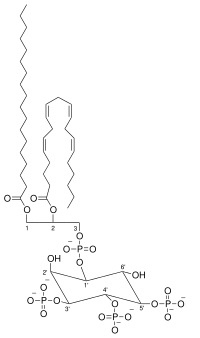
| ホスファチジルイノシトール-3,4,5-トリスリン酸
|
|
Âà•Áß∞ PI(3,4,5)P3, PtdIns(3,4,5)P3 |
| 特性
|
| 化学式
|
C47H86O22P4
|
| モル質量
|
1126.46 g/mol, neutral with fatty acid composition - 18:0, 20:4
|
| ÁâπË®ò„Å™„ÅçÂÝ¥Âêà„ÄÅ„Éá„ɺ„Çø„ÅØÂ∏∏Ê∏© (25 °C)„ɪÂ∏∏Âúß (100 kPa) „Å´„Åä„Åë„Çã„ÇÇ„ÅÆ„Åß„ÅÇ„Çã„ÄÇ
|
ホスファチジルイノシトール-3,4,5-トリスリン酸(英: Phosphatidylinositol 3,4,5-trisphosphate、略称: PtdIns(3,4,5)P3、PI(3,4,5)P3、PIP3)は、クラスI PI3キナーゼによるホスファチジルイノシトール-4,5-ビスリン酸(PI(4,5)P2)のリン酸化による産物である。ホスファチジルイノシトール-3,4,5-三リン酸やホスファチジルイノシトール三リン酸とも呼ばれる。PIP3は細胞膜に位置するリン脂質である。
発見
1988Âπ¥„Å´„É´„ǧ„Çπ„ɪ„Ç´„É≥„Éà„ɨ„ɺ„ÅØ„Äńǧ„Éé„Ç∑„Éà„ɺ„É´Áí∞„ÅÆ3'‰Ωç„Çí„É™„É≥ÈÖ∏Âåñ„Åó„Ŷ„Éõ„Çπ„Éï„Ç°„ÉÅ„Ç∏„É´„ǧ„Éé„Ç∑„Éà„ɺ„É´-3-„É™„É≥ÈÖ∏„ÇíÂΩ¢Êàê„Åô„Çã„Å®„ÅÑ„ÅÜ„ÄÅ„Åù„Çå„Åæ„ÅßÁü•„Çâ„Çå„Ŷ„ÅÑ„Å™„Åã„Å£„ÅüÊ¥ªÊÄß„ÇíÊåńŧÊñ∞„Åü„Å™„Çø„ǧ„Éó„ÅÆ„Éõ„Çπ„Éõ„ǧ„Éé„Ç∑„ÉÅ„Éâ„Ç≠„Éä„ɺ„Ǻ„ÅÆÁô∫˶ã„Å´„ŧ„ÅфŶˮò˺â„Åó„ÅüË´ñÊñá„ÇíÁô∫Ë°®„Åó„Åü[1]„ÄÇ„Åù„Çå„Å®„ÅØÁã¨Á´ã„Åó„ŶAlexis Traynor-Kaplan„Çâ„ÅØ„ÄÅÊñ∞„Åü„Å™ËÑÇË≥™„Éõ„Çπ„Éï„Ç°„ÉÅ„Ç∏„É´„ǧ„Éé„Ç∑„Éà„ɺ„É´-3,4,5-„Éà„É™„Çπ„É™„É≥ÈÖ∏„Åå„Éí„Éà„ÅÆÂ•Ω‰∏≠ÁêÉ„Åß„Åا©ÁÑ∂„Å´Â≠òÂú®„Åó„ÄÅ˵∞ÂåñÊÄß„Éö„Éó„ÉÅ„Éâ„Å´„Çà„ÇãÁîüÁêÜÁöÑÂà∫ÊøÄ„Å´„Çà„Å£„ŶÊÄ•ÊøĄŴ¢óÂäÝ„Åô„Çã„Åì„Å®„ÇíÁ§∫„Åó„ÅüË´ñÊñá„ÇíÁô∫Ë°®„Åó„Åü[2]„ÄÇ„Åù„ÅÆÂæå„ÅÆÁÝîÁ©∂„Å´„Çà„Å£„Ŷ„ÄÅ„Ç´„É≥„Éà„ɨ„ɺ„ÅÆ„Ç∞„É´„ɺ„Éó„Å´„Çà„Å£„ŶÂêåÂÆö„Åï„Çå„ÅüÈÖµÁ¥Ý„ÅØin vivo„Åß„ÅÆÂü∫Ë≥™„Å®„Åó„ŶPI(4,5)P2„ÇíÂ•Ω„Åø„ÄÅPIP3„ÇíÁî£Áîü„Åô„Çã„Åì„Å®„ÅåÁ§∫„Åï„Çå„Åü[3]„ÄÇ
機能
PIP3„ÅÆÊ©üËÉΩ„Å؉∏ãʵńÅÆ„Ç∑„Ç∞„Éä„É´‰ºùÈÅîÂõÝÂ≠ê„ÇíÊ¥ªÊÄßÂåñ„Åô„Çã„Åì„Å®„Åß„ÅÇ„Çã„Älj∏ãʵÅÂõÝÂ≠ê„Å®„Åó„ŶÊúÄ„ÇÇÁâπÁ≠Ü„Åô„Åπ„Åç„ÇÇ„ÅÆ„ÅÆ1„ŧ„Åå„Éó„É≠„É܄ǧ„É≥„Ç≠„Éä„ɺ„Ǻ Akt„Åß„ÅÇ„Çä„ÄÅAkt„ÅØÁ¥∞ËÉû„ÅÆ¢óÊÆñ„Å®ÁîüÂ≠ò„Å´ÂøÖ˶ńř‰∏ãʵńÅÆÂêåÂåñ„Ç∑„Ç∞„Éä„É´‰ºùÈÅîÁµåË∑Ø„ÇíÊ¥ªÊÄßÂåñ„Åô„Çã„ÄÇ
PIP3はホスファターゼ PTENによって3'位が脱リン酸化され、PI(4,5)P2が形成される。また、SHIP(SH2-containing inositol phosphatase)によって5'位が脱リン酸化され、PI(3,4)P2が形成される。
§ö„Åè„ÅÆ„Çø„É≥„Éë„ÇØË≥™„Å´Â≠òÂú®„Åô„ÇãPH„Éâ„É°„ǧ„É≥ÔºàËã±Ë™ûÁâàÔºâ„ÅåPIP3„ÇíÁµêÂêà„Åô„Çã„ÄÇ„Åì„ÅÆ„Çà„ÅÜ„Å™„Çø„É≥„Éë„ÇØË≥™„Å´„ÅØAkt„ÄÅPDK1ÔºàËã±Ë™ûÁâàÔºâ„ÄÅBtk„ÄÅARNOÔºàËã±Ë™ûÁâàÔºâ„ÅåÂê´„Åæ„Çå„Çã„ÄÇ„ÇØ„É©„ÇπI PI3„Ç≠„Éä„ɺ„Ǻ„ÅÆÊ¥ªÊÄßÂåñ„Å´‰º¥„ÅÜÁ¥∞ËÉûËÜú„Åß„ÅÆPIP3„ÅÆÂΩ¢Êàê„ÅØ„Åì„ÅÜ„Åó„Åü„Çø„É≥„Éë„ÇØË≥™„ÅÆÁ¥∞ËÉûËÜú„Å∏„ÅÆÁߪ˰å„Çíºï„Åç˵∑„Åì„Åó„ÄÅ„Åì„Çå„Çâ„ÅÆÊ¥ªÊÄß„Å´ÂΩ±Èüø„Çí‰∏é„Åà„Çã„Äǧö„Åè„ÅÆ„Çø„ǧ„Éó„ÅÆÁúüÊÝ∏Á¥∞ËÉû„Å´„Åä„ÅфŶ„ÄÅPIP3„ÅÆÁî£Áîü„Å®PH„Éâ„É°„ǧ„É≥Âê´Êúâ„Çø„É≥„Éë„ÇØË≥™„ÅÆÁ¥∞ËÉûËÜú„Å∏„ÅÆ„É™„ÇØ„É´„ɺ„Éà„Å´„Çà„Å£„Ŷ±ÄÊâÄÁöÑ„Å™„Ç¢„ÇØ„ÉÅ„É≥ÈáçÂêà„Ååºï„Åç˵∑„Åì„Åï„Çå„ÄÅÁ¥∞ËÉû„ÅÆÈÅä˵∞„ÇÑÂàÜˣDŽÄÅÈ£ü‰ΩúÁŴÈáç˶ńřÁ¥∞ËÉûÁ™Å˵∑„ÅåÂΩ¢Êàê„Åï„Çå„Çã[4]„ÄÇ
PHドメインはPIP3とGタンパク質共役受容体キナーゼ(GRK)との結合を可能にする。これによってGRKの細胞膜への結合が強化される。
出典