| klór-monofluorid
|
![]()
|

|
| IUPAC-név |
klór-monofluorid
|
| Más nevek |
klór-fluorid
|
| Kémiai azonosítók
|
| CAS-szám |
7790-89-8
|
| PubChem |
123266
|
| ChemSpider |
109879
|
|
|
|
|
| InChIKey |
OMRRUNXAWXNVFW-UHFFFAOYSA-N
|
| Kémiai és fizikai tulajdonságok
|
| Kémiai képlet |
ClF
|
| Moláris tömeg |
54,45 g/mol
|
| Sűrűség |
1,62 g/ml
(folyadék, −100 °C)
|
| Olvadáspont |
−155,6 °C
|
| Forráspont |
−100,1 °C
|
| Kristályszerkezet
|
| Dipólusmomentum |
0,881 D
(2,94·10−30 C m)
|
| Termokémia
|
Std. képződési
entalpia ΔfHo298 |
−56,5 kJ mol−1
|
Standard moláris
entrópia So298 |
217,91 J K−1 mol−1
|
| Hőkapacitás, C |
33,01 J K−1 mol−1
|
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak.
|
A klór-monofluorid az interhalogének közé tartozó illékony vegyület, képlete ClF. Színtelen, szobahőmérsékleten gáz halmazállapotú anyag, mely magas hőmérsékleten is stabil. Forráspontja −100°C, folyadékként halványsárga színű. Sok tulajdonsága köztes értéket képvisel a klór és a fluor megfelelő tulajdonságaihoz képest.[1] 1928-ban fedezte fel Otto Ruff.[2]
Előállítása
Előállítható elemi klór és fluor 250 °C-on, rézreszelék jelenlétében végzett reakciójával.[2]
Reakciói
Sokoldalú fluorozó szer, fémekkel és nemfémekkel fluoridokat képez, a reakció során klórgáz szabadul fel. Volfrámmal reagálva például volfrám-hexafluorid, szelénnel szelén-tetrafluorid keletkezik:
W + 6 ClF → WF6 + 3 Cl2
Se + 4 ClF → SeF4 + 2 Cl2
Fluorozási-klórozási reakcióba is léphet oxidáció vagy többszörös kötésekre történő addíció révén. A szén-monoxid hármas kötésére például fluort és klórt addíciónál:
C≡O + ClF → 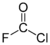
Fordítás
Ez a szócikk részben vagy egészben a Chlorine monofluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
- ↑ Otto Ruff, E. Ascher (1928). „Über ein neues Chlorfluorid-CIF3”. Zeitschrift für anorganische und allgemeine Chemie 176 (1), 258–270. o. DOI:10.1002/zaac.19281760121.
- ↑ a b Arnold F. Holleman, Egon Wiberg, Nils Wiberg: Lehrbuch der anorganischen Chemie, 101. Auflage, 465–466. oldal, Walter de Gruyter, 1995, ISBN 3-11-012641-9; Google Books.