„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ы„Щ„Ю„Щ „Р„Х „©„Щ„Х„Х„Щ „Ю„©„І„Ь „У„Щ„†„Ю„Щ („фЄ†„Т„Ь„Щ„™: Chemical equilibrium) „Ф„Х„Р „Ф„©„Ь„С „С„™„Т„Х„С„Ф „Ф„Ы„Щ„Ю„Щ„™ „©„С„Х „Ф„®„Ы„С „™„Ґ„®„Х„С„™ „Ф„™„Т„Х„С„Ф „Ь„Р „Ю„©„™„†„Ф „Ґ„Х„У. „Ц„Ф„Х „Ю„¶„С „У„Щ„†„Ю„Щ, „Ы„Ь„Х„Ю„®, „Р„Щ„Я „Ф„Ґ„У„§„Ф „Р„†„®„Т„Ш„Щ„™ „Ь„Ф„™„І„У„Ю„Х„™ „Ф„™„Т„Х„С„Ф „Ь„Ы„Ь „Ы„Щ„Х„Х„Я „Х„Ґ„Ь „Ы„Я „Р„Щ„Я „©„Щ„†„Х„Щ „С„Ю„¶„С „Ф„Ю„Т„Щ„С„Щ„Э „Ь„Р„Х„®„Ъ „Ц„Ю„Я.
„Ф„Ю„У„Ґ „Ф„Ґ„Х„Ю„У „фф°„Щ„° „™„Х„®„™ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ф„Ы„Щ„Ю„Щ „Ф„Х„Р „ބЄф†„Щ „Ф„Щ„°„Х„У „Ф„Ч„©„Х„С„Щ„Э „С„Щ„Х„™„® „С„™„Ы„†„Х„Я „©„Ь „™„Т„Х„С„Х„™ „Ы„Щ„Ю„Щ„Х„™ „С„Ю„Ґ„С„У„Ф „Х„С„™„Ґ„©„Щ„Щ„Ф, „Х„Ю„Ю„Х„І„У„Щ „Ф„Ґ„Щ„°„Х„І „Ф„Ю„®„Ы„Ц„Щ„Щ„Э „©„Ь „Ю„Ф„†„У„°„Щ „Ы„Щ„Ю„Щ„Ф „Х„Ы„Щ„Ю„Р„Щ„Э.
„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ф„Х„Ю„Х„Т„†„Щ „Х„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ф„Ш„®„Х„Т„†„Щ
„С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ф„Х„Ю„Х„Т„†„Щ (homogeneous equilibrium), „Ы„Ь „Ф„Ю„Т„Щ„С„Щ„Э „Х„Ы„Ь „Ф„™„Х„¶„®„Щ„Э „†„Ю„¶„Р„Щ„Э „С„§„Р„Ц„Ф „Р„Ч„™. „Ь„У„Х„Т„Ю„Ф, „†„Щ„™„Я „Ь„¶„Щ„Щ„Я „Р„™ „Ф„™„Т„Х„С„Ф:

„С„Ф „Ы„Ь „Ф„Ч„Х„Ю„®„Щ„Э „Ф„Ю„Ґ„Х„®„С„Щ„Э „†„Ю„¶„Р„Щ„Э „С„¶„Х„®„Ф „Т„Ц„Щ„™. „Ь„Ґ„Х„Ю„™ „Ц„Р„™ „Ф„™„Т„Х„С„Ф:

„С„Ф „Ч„Х„Ю„¶„Ф „Ф„Щ„У„®„Х„С„®„Х„Ю„Щ„™ „Ю„Ф„Х„Ь„Ф „Ю„Т„Щ„С„Ф „Ґ„Э „™„Ю„Щ„°„™ „Р„©„Ь„Т„Я „Ч„†„І„™„Щ, „Ь„І„С„Ь„™ „™„Ю„Щ„°„Ф „Ю„Щ„Ю„Щ„™ „©„Ь „Р„©„Ь„Т„Я „С„®„Х„Ю„Щ „Х„Ч„Х„Ю„¶„Ф „Ч„†„І„™„Щ„™. „Ю„Ф„Х„Х„Ф „У„Х„Т„Ю„Ф „Ь„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ф„Х„Ю„Х„Т„†„Щ „С„§„Р„Ц„Ф „Ф„†„Х„Ц„Ь„Щ„™.
„С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ф„Ш„®„Х„Т„†„Щ (heterogeneous equilibrium), „Ф„Ю„Т„Щ„С„Щ„Э „Х„Ф„™„Х„¶„®„Щ„Э „†„Ю„¶„Р„Щ„Э „С„Щ„Х„™„® „Ю„§„Р„Ц„Ф „Р„Ч„™. „Ь„У„Х„Т„Ю„Ф, „Ф„™„Т„Х„С„Ф „С„Щ„Я „©„фф٠„Єф• „Ю„™„Ы„™„Щ „Ґ„Э „І„Щ„Ш„Х„® („Р„У„Щ „Ю„Щ„Э) „Ь„Щ„¶„Щ„®„™ „Єф• „Ч„Ю„¶„†„Щ („Ю„Х„¶„І) „Х„Ю„Щ„Ю„Я „Т„Ц„Щ, „Ы„Х„Ь„Ь „©„™„Щ „§„Р„Ц„Х„™, „Ю„Х„¶„І „Х„Т„Ц:

„фЄՄ§„Я „Ы„Ь„Ь„Щ, „™„Т„Х„С„Х„™ „Ы„Щ„Ю„Щ„Х„™ „Щ„Т„Щ„Ґ„Х „Ь„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ю„Ф„Щ„® „Щ„Х„™„® „С„§„Р„Ц„Ф „Ф„Т„Ц„Щ„™ „Р„Х „Ф„†„Х„Ц„Ь„Щ„™, „©„Ы„Я „С„Ю„¶„С„Щ „¶„С„Щ„®„Ф „Р„Ь„Х „Р„Щ„Я „Ю„Т„С„Ь„Ф „Ю„©„Ю„Ґ„Х„™„Щ„™ „Ґ„Ь „Ф„І„Щ„†„Ш„Щ„І„Ф „©„Ь „Ф„™„Т„Х„С„Ф.
„¶„Х„®„™ „Ф„®„Щ„©„Х„Э „Ф„Ю„Х„°„Ы„Ю„™
„Ґ„С„Х„® „Ф„™„Т„Х„С„Ф „Ф„Ы„Ь„Ь„Щ„™ „С„Щ„Я „Ф„Ю„Т„Щ„С„Щ„Э A „Х-B „Ь„І„С„Ь„™ „Ф„™„Х„¶„®„Щ„Э C „Х-D:

„Р„Э „Ф„™„Т„Х„С„Ф „†„Ю„¶„Р„™ „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь, „Р„Ц„Щ „†„©„™„Ю„© „С„Ч„• „Ы„§„Х„Ь ( ), „Ф„Ю„¶„С„Щ„Ґ „Ґ„Ь „Ы„Ъ „©„©„™„Щ „Ф„™„Т„Х„С„Х„™ („Ф„І„У„Ю„Щ„™ вАУ „Ь„Щ„¶„Щ„®„™ „Ф„™„Х„¶„®„Щ„Э, „Х„Ф„Ф„§„Х„Ы„Ф вАУ „Ь„Щ„¶„Щ„®„™ „Ф„Ю„Т„Щ„С„Щ„Э) „Ю„™„®„Ч„©„Х„™ „С„І„¶„С „Ц„Ф„Ф.
), „Ф„Ю„¶„С„Щ„Ґ „Ґ„Ь „Ы„Ъ „©„©„™„Щ „Ф„™„Т„Х„С„Х„™ („Ф„І„У„Ю„Щ„™ вАУ „Ь„Щ„¶„Щ„®„™ „Ф„™„Х„¶„®„Щ„Э, „Х„Ф„Ф„§„Х„Ы„Ф вАУ „Ь„Щ„¶„Щ„®„™ „Ф„Ю„Т„Щ„С„Щ„Э) „Ю„™„®„Ч„©„Х„™ „С„І„¶„С „Ц„Ф„Ф.
„Ф„Р„Х„™„Щ„Х„™ a, b, c, d „Ф„Э „Ф„Ю„І„У„Ю„Щ„Э „Ф„°„Ш„Х„Ы„Щ„Х„Ю„Ш„®„Щ„Э „©„Ь „Ф„™„Т„Х„С„Ф.
„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ф„Х„Р „Ґ„®„Ъ „Ю„°„§„®„Щ „Ф„Ю„С„Ш„Р „Р„™ „Щ„Ч„° „Ю„Ы„§„Ь„™ „®„Щ„Ы„Х„Ц„Щ „Ф„™„Х„¶„®„Щ„Э „С„Ю„Ы„§„Ь„™ „®„Щ„Ы„Х„Ц„Щ „Ф„Ю„Т„Щ„С„Щ„Э „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь. „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ю„С„Ш„Р „Р„™ „Ф„®„Ы„С „Ф„Ю„Ґ„®„Ы„™ „Ф„Ы„Щ„Ю„Щ„™ „С„Ю„¶„С „Ц„Ф.
„Ґ„С„Х„® „Ф„™„Т„Х„С„Ф „Ф„Ы„Ь„Ь„Щ„™ „С„Щ„Я „Ф„Ю„Т„Щ„С„Щ„Э A „Х-B „Ь„І„С„Ь„™ „Ф„™„Х„¶„®„Щ„Э C „Х-D, „Ф„†„Ю„¶„Р„™ „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь:

„Щ„©„†„Я 2 „Ф„Т„У„®„Х„™ „©„Щ„Ю„Х„©„Щ„Х„™ „Ь„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ю„©„І„Ь („Ф„Ю„°„Х„Ю„Я „фЄՄ™ K), „ԄބՄфЄՄ™ „С„Ш„С„Ь„Ф „ԄфЄФ:
„У„Т„©„Щ„Э:
- „Ґ„®„Ы„Х „©„Ь „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ю„©„™„†„Ф „Ю„™„Т„Х„С„Ф „Ь„™„Т„Х„С„Ф, „Х„Ф„Х„Р „™„Ь„Х„Щ „С„Ш„Ю„§„®„Ш„Х„®„Ф.
- „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Р„Щ„†„Х „Ю„Ь„Ю„У „Ґ„Ь „Ю„Ф„Щ„®„Х„™ „Ф„™„Т„Х„С„Ф „Р„Ь„Р „®„І „Ґ„Ь „Ф„®„Ы„С „Ф„Ю„Ґ„®„Ы„™ „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь.
- „Ч„Х„Ю„®„Щ„Э „©„Ф„Э „†„Х„Ц„Ь„Щ„Э „Р„Х „Ю„Х„¶„І„Щ„Э „Ш„Ф„Х„®„Щ„Э, „Р„Щ„†„Э „†„Ы„†„°„Щ„Э „Ь„Ч„Щ„©„Х„С „Ґ„®„Ы„Щ „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь.
_________________________________________________________
„Ь„У„Х„Т„Ю„Ф, „Ґ„С„Х„® „Ф„™„Т„Х„С„Ф „Ь„Щ„Щ„¶„Х„® „Ф„Р„Ю„Х„†„Щ„Ф („™„Ф„Ь„Щ„Ъ „Ф„С„®-„С„Х„©):

„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь  „Щ„С„Х„Ш„Р „фЄՄ§„Я „Ф„С„Р:
„Щ„С„Х„Ш„Р „фЄՄ§„Я „Ф„С„Р:

_________________________________________________________
„Ь„У„Х„Т„Ю„Ф, „Ґ„С„Х„® „Ф„™„Т„Х„С„Ф „Ь„Ф„Ы„†„™ „°„Щ„У„Я „Ч„Ю„¶„†„Щ („°„Щ„У „Ч„Щ) „Ю„°„Щ„У„Я „§„Ч„Ю„™„Щ:

„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь  „Щ„С„Х„Ш„Р „фЄՄ§„Я „Ф„С„Р:
„Щ„С„Х„Ш„Р „фЄՄ§„Я „Ф„С„Р:
 , „Х„Р„Щ„Я „Ю„Ч„©„Щ„С„Щ„Э „Р„™
, „Х„Р„Щ„Я „Ю„Ч„©„Щ„С„Щ„Э „Р„™  „Х„Р„™
„Х„Р„™  „Ы„Щ „Ф„Э „Ю„Х„¶„І„Щ„Э „Ш„Ф„Х„®„Щ„Э.
„Ы„Щ „Ф„Э „Ю„Х„¶„І„Щ„Э „Ш„Ф„Х„®„Щ„Э.
| „Ю„†„Щ„§„Х„Ь„¶„Щ„Х„™ „Ґ„Ь „І„С„Х„Ґ„Щ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
|
| „Ф„Ю„©„Х„Х„Р„Ф
|
„Ф„С„Щ„Ш„Х„Щ „Ь„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
|
„Ф„°„С„®
|

|

|
„Ф„Т„У„®„Ф „Ы„Ь„Ь„Щ„™
|

|

|
„Ф„§„Щ„Ы„™ „Ф„™„Т„Х„С„Ф, „Ю„С„Щ„Р„Ф „Ь„Ф„§„Щ„Ы„™ „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
|

|

|
„Ф„Ы„§„Ь„™ „Ф„™„Т„Х„С„Ф „С„Ю„І„У„Э „Ю„Х„Ь„®„Щ (n) „Ю„С„Щ„Р„Ф „Ь„Ф„Ґ„Ь„Р„™ „Ф„І„С„Х„Ґ „С„Ч„Ц„І„Ф „Ф„Ю„™„Р„Щ„Ю„Ф „Ь„Ю„І„У„Э
|
| „Ф„Ґ„®„Ф: „С„Ч„Щ„С„Х„® „©„Ь „™„Т„Х„С„Х„™ „Ы„Щ„Ю„Щ„Х„™, „†„Щ„™„Я „Ь„Ф„Ы„§„Щ„Ь „Р„™ „І„С„Х„Ґ„Щ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Р„Ь„Х „С„Р„Ь„Х „Ы„У„Щ „Ь„І„С„Ь „Р„™ „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ь„™„Т„Х„С„Ф „Ф„Ы„Х„Ь„Ь„™.
|
„Ю„©„Ю„Ґ„Х„™ „Ґ„®„Ы„Х „©„Ь „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
„Ґ„®„Ъ „Т„С„Х„Ф „©„Ь K „Ю„¶„Щ„Щ„Я „Ы„Щ, „Ф„Ю„Х„†„Ф „Т„У„Х„Ь „Щ„Ч„°„Щ„™ „Ь„Ю„Ы„†„Ф „ффل؄Մ٠„©„Ь K. „§„Щ„®„Х„© „Ф„У„С„® „Ы„Щ, „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „®„Щ„Ы„Х„Ц„Щ „Ф„™„Х„¶„®„Щ„Э „Т„У„Х„Ь„Щ„Э „С„Ф„©„Х„Х„Р„Ф „Ь„Р„Ь„Ф „©„Ь „Ф„Ю„Т„Щ„С„Щ„Э, „Х„Ь„Ы„Я „Ф„™„Т„Х„С„Ф „Ф„Ф„§„Щ„Ы„Ф „Ф„†"„Ь „†„Х„Ш„Ф „Щ„Х„™„® „Ь„Ы„Щ„Х„Х„Я „Щ„Ю„Щ„†„Ф, „Ы„Ь„Х„Ю„® - „Ь„Ы„Щ„Х„Х„Я „Щ„¶„Щ„®„™ „Ф„™„Х„¶„®„Щ„Э (C „Х-D) „Ґ„Ь „Ч„©„С„Х„Я „Ф„Ю„Т„Щ„С„Щ„Э (A „Х-B). „Ю„¶„У „©„†„Щ, „Ы„Р„©„® K „І„Ш„Я, „Ф„У„С„® „Ю„Х„®„Ф „Ґ„Ь „Щ„Ч„° „І„Ш„Я „С„Щ„Я „Ф„™„Х„¶„®„Щ„Э „Ь„Ю„Т„Щ„С„Щ„Э, „©„Ю„©„Ю„Ґ„Х„™„Х - „Щ„Х„™„® „Ю„Т„Щ„С„Щ„Э „Ґ„Ь „Ч„©„С„Х„Я „Ф„™„Х„¶„®„Щ„Э.
„Ч„Щ„©„Х„С „Ґ„®„Ы„Х „©„Ь „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „С„Ш„Ю„§„®„Ш„Х„®„Ф „©„Х„†„Ф
„†„Щ„™„Я „Ь„Ч„©„С „Р„™ „Ґ„®„Ъ „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь, „©„Ь „™„Т„Х„С„Ф „Ф„Ю„™„®„Ч„©„™ „С„™„Ф„Ь„Щ„Ъ „Р„Щ„Ц„Х„Ы„Х„®„Щ („†„§„Ч „І„С„Х„Ґ) „Ґ„С„Х„® „Ы„Ь „Ш„Ю„§„®„Ш„Х„®„Ф, „Ґ„Ь „§„Щ „Ю„©„Х„Х„Р„™ „Х„Р„Я '„Ш „Ф„Х„£:

„Ы„©- „Ф„Х„Р „©„Щ„†„Х„Щ „Ф„Р„†„™„Ь„§„Щ„Ф „Ф„™„І„†„Щ „С„™„Т„Х„С„Ф „Х-
„Ф„Х„Р „©„Щ„†„Х„Щ „Ф„Р„†„™„Ь„§„Щ„Ф „Ф„™„І„†„Щ „С„™„Т„Х„С„Ф „Х- „Ф„Х„Р „І„С„Х„Ґ „Ф„Т„Ц„Щ„Э.
„Ф„Х„Р „І„С„Х„Ґ „Ф„Т„Ц„Щ„Э.
„Ф„І„©„® „С„Щ„Я „Ф„Р„†„®„Т„Щ„Ф „Ф„Ч„Х„§„©„Щ„™ „Ь„І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
„Ф„І„©„® „С„Щ„Я „Ф„Р„†„®„Т„Щ„Ф „Ф„Ч„Х„§„©„Щ„™ „©„Ь „Ф„™„Т„Х„С„Ф ( ) „Ь„Ф„®„Ы„С „™„Ґ„®„Х„С„™ „Ф„™„Т„Х„С„Ф „С„Ы„Ь „©„Ь„С „©„Ь „Ф„™„Т„Х„С„Ф, „†„™„Х„Я „Ґ„Ь „Щ„У„Щ „Ф„Ю„©„Х„Х„Р„Ф „ԄфЄФ:
) „Ь„Ф„®„Ы„С „™„Ґ„®„Х„С„™ „Ф„™„Т„Х„С„Ф „С„Ы„Ь „©„Ь„С „©„Ь „Ф„™„Т„Х„С„Ф, „†„™„Х„Я „Ґ„Ь „Щ„У„Щ „Ф„Ю„©„Х„Х„Р„Ф „ԄфЄФ:

„Ы„©-Q „Ф„Х„Р „Ю„†„™ „Ф„™„Т„Х„С„Ф: ![{\displaystyle Q={\frac {[C]^{c}[D]^{d}}{[A]^{a}[B]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0778b4166f5655862c440dc0d6f506d8f5ba847e) „Р„Ь„Р „©„Ф„Х„Р „Ь„Р „Ю„С„Ш„Р „С„Ф„Ы„®„Ч „Ю„¶„С „©„Ь „©„Щ„Х„Х„Щ „Ю„©„І„Ь, „Р„Ь„Р „®„І „Ю„С„Ш„Р „Р„™ „Ф„®„Ы„С „Ф„Ю„Ґ„®„Ы„™ „С„†„І„Х„У„Ф „Ю„°„Х„Щ„Ю„™ „С„Ц„Ю„Я.
„Р„Ь„Р „©„Ф„Х„Р „Ь„Р „Ю„С„Ш„Р „С„Ф„Ы„®„Ч „Ю„¶„С „©„Ь „©„Щ„Х„Х„Щ „Ю„©„І„Ь, „Р„Ь„Р „®„І „Ю„С„Ш„Р „Р„™ „Ф„®„Ы„С „Ф„Ю„Ґ„®„Ы„™ „С„†„І„Х„У„Ф „Ю„°„Х„Щ„Ю„™ „С„Ц„Ю„Я.
„Ю„Ы„Р„Я „©„С„Ю„Щ„У„Ф „Х„Щ„У„Х„Ґ „©„Ф„Ю„Ґ„®„Ы„™ „†„Ю„¶„Р„™ „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Р„Ц„Щ:  ,
,  „Х„Ю„Ы„Р„Я:
„Х„Ю„Ы„Р„Я: 
„Х„Ь„Ы„Я: 
„Ґ„Щ„І„®„Х„Я „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф „Х„Ф„™„†„Ф„Т„Х„™ „Ю„Ґ„®„Ы„™ „Ы„Щ„Ю„Щ„™ „Ы„™„Х„¶„Р„Ф „Ю„Щ„¶„Щ„Р„Ф „Ю„©„Щ„Х„Х„Щ „Ю„©„І„Ь
![]() „Р„†„®„Щ „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф, 1850-1936
„Р„†„®„Щ „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф, 1850-1936
„Ф„Р„Х„§„Я „С„Х „Ю„Ґ„®„Ы„™ „Ы„Щ„Ю„Щ„™ „Ю„™„†„Ф„Т„™ „С„™„Т„Х„С„Ф „Ь„Щ„¶„Щ„Р„Ф „Ю„©„Щ„Х„Х„Щ „Ю„©„І„Ь „†„Х„°„Ч „Ґ„Ь „Щ„У„Щ „Ф„Ы„Щ„Ю„Р„Щ „Ф„¶„®„§„™„Щ „Р„†„®„Щ „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф, „Х„Ю„Ы„Х„†„Ф „Ґ„Ь „©„Ю„Х: „Ґ„І„®„Х„Я „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф.
„Ф„Т„У„®„Ф „®„©„Ю„Щ„™:
"„Ы„Р„©„® „Ю„§„Ґ„Щ„Ь„Щ„Э „Ґ„І„Ф („°„Ш„®„°) „Ґ„Ь „Ю„Ґ„®„Ы„™ „Ф„Ю„¶„Х„Щ„Ф „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „У„Щ„†„Ю„Щ, „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „†„Х„Ш„Ф „Ь„Ф„©„™„†„Х„™ „С„У„®„Ъ „Ф„Ю„Ю„Ц„Ґ„®„™ „Р„™ „Ф„©„§„Ґ„™ „Ф„Ґ„І„Ф"
„Ы„Ь„Х„Ю„®, „Ф„Ю„Ґ„®„Ы„™ „™„©„Р„£ „Ь„Ю„Ц„Ґ„® „Р„™ „Ф„©„§„Ґ„™„Я „©„Ь „Ґ„І„Х„™ „Ф„Ю„Х„§„Ґ„Ь„Х„™ „Ґ„Ь„Щ„Ф „Ґ„Ь „Щ„У„Щ „С„Щ„¶„Х„Ґ „©„Щ„†„Х„Щ„Щ„Э „§„†„Щ„Ю„Щ„Щ„Э „©„Ю„Ш„®„™„Я „Ь„Ч„Ц„Х„® „Ь„©„Щ„Х„Х„Щ „Ю„©„І„Ь.
| „Ґ„І„Х„™ „©„Ы„Щ„Ч„Х„™ „Х„Ф„©„§„Ґ„™„Я „Ґ„Ь „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь
|
| „Ф„Ґ„І„Ф
|
„Ф„©„§„Ґ„Х„™
|
| „©„Щ„†„Х„Щ „Ш„Ю„§„®„Ш„Х„®„Ф
|
„Ф„Ґ„Ь„Р„™ „Ф„Ш„Ю„§„®„Ш„Х„®„Ф „©„Ь „™„Т„Х„С„Ф „Р„І„°„Х„™„®„Ю„Щ„™ „™„С„Щ„Р „Ь„Ф„Ґ„У„§„Ф „Ф„™„Т„Х„С„Ф „Ф„Ф„Х„§„Ы„Щ„™ („Ф„Р„†„У„Х„™„®„Ю„Щ„™) „©„™„С„Щ„Р „Ь„Щ„Щ„¶„Х„® „Ф„Ю„Т„Щ„С„Щ„Э, „Х„Ь„Ф„§„Ъ.
|
| „™„С„Щ„Р „Ь„©„Щ„†„Х„Щ „І„С„Х„Ґ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь.
|
| „©„Щ„†„Х„Щ „Ь„Ч„• / „†„§„Ч
|
„У„Ч„Щ„°„Ф „©„Ь „™„Ґ„®„Х„С„™ „™„Т„Х„С„Ф „С„©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ю„†„Щ„Ґ„Ф „Р„™ „Ф„™„Т„Х„С„Ф „С„Ы„Щ„Х„Х„Я „Ф„Ю„І„Ш„Щ„Я „Р„™ „Ю„°„§„® „Ф„Ю„Х„Ь„І„Х„Ь„Х„™ „С„§„Р„Ц„Ф „Ф„Т„Ц„Щ„™ („Ф„Ґ„®„Ф: „Ь„Ф„Ґ„Ь„Р„™ „Ф„Ь„Ч„• „Ґ„Ь „Щ„У„Щ „Ф„Х„°„§„™ „Т„Ц „Р„У„Щ„© „Р„Щ„Я „Ф„©„§„Ґ„Ф „Ґ„Ь „Ф„®„Ы„С „Ф„©„Щ„Х„Х„Щ „Ю„©„І„Ь).
|
| „Ф„Х„°„§„™ „Ц„®„Ц
|
„Ь„Р „™„©„§„Щ„Ґ „Ґ„Ь „Ф„®„Ы„С „Ф„©„Щ„Х„Х„Щ „Ю„©„І„Ь, „Р„Ь„Р „®„І „™„Р„Щ„• „Р„™ „І„¶„С „Ф„Ф„Т„Ґ„Ф „Ь„©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь.
|
„Ч„©„Щ„С„Х„™ „™„Ґ„©„Щ„Щ„™„Щ„™
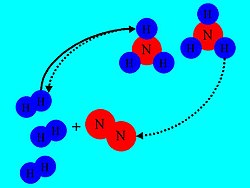 „°„Ы„Щ„Ю„Ф „Ф„Ю„™„Р„®„™ „Р„™ „™„Ф„Ь„Щ„Ъ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „С„Щ„Я „Ю„Х„Ь„І„Х„Ь„Х„™ „Ю„Щ„Ю„Я „Х„Ч„†„І„Я „Ь„С„Щ„Я „Ю„Х„Ь„І„Х„Ь„Х„™ „Р„Ю„Х„†„Щ„Ф
„°„Ы„Щ„Ю„Ф „Ф„Ю„™„Р„®„™ „Р„™ „™„Ф„Ь„Щ„Ъ „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „С„Щ„Я „Ю„Х„Ь„І„Х„Ь„Х„™ „Ю„Щ„Ю„Я „Х„Ч„†„І„Я „Ь„С„Щ„Я „Ю„Х„Ь„І„Х„Ь„Х„™ „Р„Ю„Х„†„Щ„Ф„Ю„®„С„Щ„™ „Ф„™„Т„Х„С„Х„™ „Ф„Ы„Щ„Ю„Щ„Х„™ „Р„Щ„†„Я „Ф„Х„Ь„Ы„Х„™ „Ґ„У „™„Х„Э, „Х„С„У„®„Ъ „Ы„Ь„Ь, „Ю„°„™„Щ„Щ„Ю„Х„™ „С„Ф„Т„Ґ„Ф „Р„Ь „©„Щ„Х„Х„Щ „Ю„©„І„Ь „С„Х „Ф„Ю„Ґ„®„Ы„™ „Ю„Ы„Щ„Ь„Ф „Ф„Я „™„Х„¶„®„Щ„Э „Х„Ф„Я „Ю„Т„Щ„С„Щ„Э, „Р„Х„Ь„Э, „С„™„Ґ„©„Щ„Щ„Ф „Щ„© „¶„Х„®„Ъ „С„™„Ы„†„Х„Я „™„Т„Х„С„Х„™ „Ґ„Э „†„Щ„¶„Х„Ь„™ „Т„С„Х„Ф„Ф, „Ы„Ь„Х„Ю„® „Р„Ч„Х„Ц „Ф„Ю„®„Ф „Т„С„Х„Ф „©„Ь „™„Х„¶„®„Щ„Э „С„Щ„Ч„° „Ь„Ю„Т„Щ„С„Щ„Э. „Ґ„Ь „Ы„Я, „Ф„Ч„©„Щ„С„Х„™ „©„Ь „™„Ы„†„Х„Я „™„Ф„Ь„Щ„Ы„Щ„Э „Х„™„Т„Х„С„Х„™ „Ь„Ф„Я „Ф„Ґ„У„§„Ф „Ь„™„Т„Х„С„Ф "„І„У„Щ„Ю„Ф" „Ф„Щ„Р „І„®„Щ„Ш„Щ„™.
„Ф„Щ„У„Ґ „Ф„†„¶„С„® „С„™„Ч„Х„Э „©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ф„Ы„Щ„Ю„Щ „Ф„Х„У„Х„™ „Ь„Р„†„®„Щ „Ь„Ф „©„Ш„Ь„Щ„Щ„Ф „Х„Ф„Ґ„Щ„І„®„Х„Я „©„†„Щ„°„Ч („С„†„Х„°„£ „Ь„™„®„Х„Ю„™„Э „©„Ь „Ы„Щ„Ю„Р„Щ„Э „†„Х„°„§„Щ„Э) „Ю„©„Ю„©„Щ„Э „Ы„С„°„Щ„° „Ф„Ю„У„Ґ„Щ „С„™„Ы„†„Х„Я „Х„§„Щ„™„Х„Ч „©„Ь „™„Т„Х„С„Х„™ „Ы„Щ„Ю„Щ„Х„™.
„†„™„С„Х„†„Я „Ь„У„Х„Т„Ю„Ф „С„™„Т„Х„С„Ф „Ь„Щ„Щ„¶„Х„® „Р„Ю„Х„†„Щ„Ф („™„Ф„Ь„Щ„Ъ „Ф„С„®-„С„Х„©), „ՄфЄՄ§„Я „С„Х „Ю„Щ„Х„©„Ю„Щ„Э „Ґ„І„®„Х„†„Х„™ „Ф„©„Щ„Х„Х„Щ „Ф„Ю„©„І„Ь „Ф„Ы„Щ„Ю„Щ „Ь„Ф„Т„У„Ь„™ „Р„Ч„Х„Ц „Ф„Ф„Ю„®„Ф „Ь„І„С„Ь„™ „Р„Ю„Х„†„Щ„Ф „Ю„Ч„Х„Ю„®„Щ „Ф„Т„Ь„Э „Ю„Щ„Ю„Я „Х„Ч„†„І„Я:

- „Ь„Ч„• - „Ф„Т„С„®„™ „Ф„Ь„Ч„• „С„Ю„Ы„Ь „Ф„™„Т„Х„С„Ф „™„С„Щ„Р „Ь„Щ„¶„Щ„®„™ „Р„Ю„Х„†„Щ„Ф - „Ю„Ы„Щ„Х„Х„Я „©„Ґ„Ь „Щ„У„Щ „Ы„Ъ „Ф„Ю„Ґ„®„Ы„™ „™„¶„Ь„Щ„Ч „Ь„Ф„І„Ш„Щ„Я „Р„™ „Ф„Ґ„І„Ф („Ф„Ь„Ч„•): „Ю„Р„®„С„Ґ„Ф „Ю„Х„Ь„Щ„Э „©„Ь „Ю„Щ„Ю„Я „Х„Ч„†„І„Я „†„Х„¶„®„Щ„Э „©„†„Щ „Ю„Х„Ь„Щ„Э „©„Ь „Р„Ю„Х„†„Щ„Ф.
- „Ш„Ю„§„®„Ш„Х„®„Ф - „Ф„™„Т„Х„С„Ф „Ь„Щ„¶„Щ„®„™ „Ф„Р„Ю„Х„†„Щ„Ф „Ф„Щ„Р „Р„І„°„Х„™„®„Ю„Щ„™ („Ы„Ь„Х„Ю„®, „§„Х„Ь„Ш„™ „Ч„Х„Э) „Х„Ь„Ы„Я, „І„Щ„®„Х„® „Ю„Ы„Ь „Ф„™„Т„Х„С„Ф „Щ„Т„®„Х„Э „Ь„Ф„Ґ„У„§„™ „Ф„™„Х„¶„®„Щ„Э - „Ы„Ь„Х„Ю„®, „Щ„¶„Щ„®„Ф „©„Ь „Р„Ю„Х„†„Щ„Ф. „Р„Х„Ь„Э, „Щ„© „Ь„©„Щ„Э „Ь„С, „©„І„Щ„®„Х„® „Щ„™„®, „Щ„Ґ„Ь„Ф „Р„™ „Ю„©„Ъ „Ф„Ц„Ю„Я „Ь„Ф„™„Ф„Х„Х„™ „Р„Ю„Х„†„Щ„Ф, „Х„Ц„Р„™ „Ю„Ы„Щ„Х„Х„Я „©„І„Щ„®„Х„® „Ю„Р„Ш „Р„™ „Ю„°„§„® „Ф„Ф„™„†„Т„©„Х„Щ„Х„™ „Х„Ь„Ы„Я „Р„™ „Ф„°„Щ„Ы„Х„Щ „Ь„Ф„™„Ф„Х„Х„™ „™„Х„¶„®„Щ„Э. „Ь„Ы„Я „С„™„Ґ„©„Щ„Щ„Ф „Ю„™„Ч„©„С„Щ„Э „ффҐ„Щ„Ф „Ц„Р„™ „Х„Ю„©„Ь„С„Щ„Э „Ч„Х„Э „Т„С„Х„Ф „Щ„Ч„°„Щ„™ „Ґ„Э „Ь„Ч„• „Т„С„Х„Ф „Х„Ы„У„Х„Ю„Ф.
- „©„Щ„†„Х„Щ „С„®„Щ„Ы„Х„Ц „Ф„Ч„Х„Ю„®„Щ„Э - „Ь„Р„Ч„® „©„Ф„Ю„Ґ„®„Ы„™ „Ф„Т„Щ„Ґ„Ф „Ь„©„Щ„Х„Х„Щ „Ю„©„І„Ь „†„Щ„™„Я „Ь„Ф„Х„¶„Щ„Р „Р„™ „Ф„Р„Ю„Х„†„Щ„Ф „Ю„Ф„Ю„Ы„Ь. „†„Щ„™„Я „Ь„Ґ„©„Х„™ „Ц„Р„™ „Ґ„Ь „Щ„У„Щ „І„Щ„®„Х„®, „™„Х„Ъ „†„Щ„¶„Х„Ь „Ф„С„У„Ь„Щ„Э „С„†„І„Х„У„™ „Ф„®„™„Щ„Ч„Ф „©„Ь „Ф„Ч„Х„Ю„®„Щ„Э „Ф„Ю„©„™„™„§„Щ„Э „С„™„Ф„Ь„Щ„Ъ. „Ф„Р„Ю„Х„†„Щ„Ф „™„Ф„Щ„Ф „†„Х„Ц„Ь„Щ„™ „С„Ґ„Х„У „©„Ф„Ю„Щ„Ю„Я „Х„Ф„Ч„†„І„Я „Щ„Щ„©„Р„®„Х „Т„Ц„Щ„Э. „Ы„Ґ„™ „Ь„§„Щ „Ґ„І„®„Х„Я „Ь„Ф-„©„Ш„Ь„Щ„Ф „Ф„Ю„Ґ„®„Ы„™ „™„©„Р„£ „Ь„Ф„Т„У„Щ„Ь „Р„™ „®„Щ„Ы„Х„Ц „Ф„™„Х„¶„® „Ю„Р„Ч„® „©„Ф„§„Ч„™„†„Х „Р„Х„™„Х. „Ю„©„Ю„Ґ: „™„Щ„Х„Х„¶„® „Ь„†„Х „Ґ„Х„У „Р„Ю„Х„†„Щ„Ф.
„Ь„І„®„Щ„Р„Ф „†„Х„°„§„™
- „§„Щ„Ш„® „Р„Ш„І„Щ„†„° „Х„Ь„Х„®„Ш„Ф „Т'„Х„†„°, „Ы„Щ„Ю„Щ„Ф „Ы„Ь„Ь„Щ„™: „Ы„®„Ъ „Р', „§„®„І 9 - „©„Щ„Х„Х„Щ „Ю„©„І„Ь „Ы„Щ„Ю„Щ, „Ф„Р„Х„†„Щ„С„®„°„Щ„Ш„Ф „Ф„§„™„Х„Ч„Ф, 2010
„І„Щ„©„Х„®„Щ„Э „Ч„Щ„¶„Х„†„Щ„Щ„Э