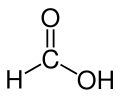
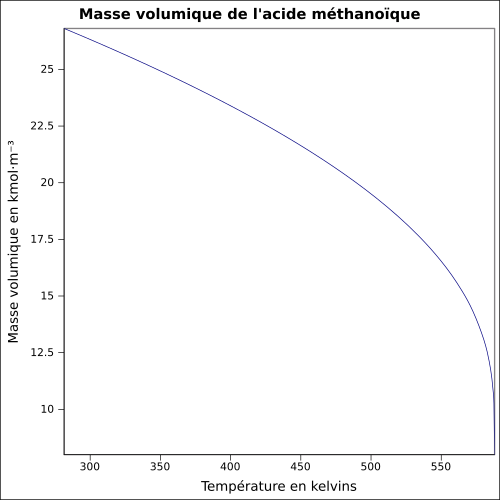
Acide méthanoïque
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Read other articles:

Asian IdolPembuatSimon FullerPresenterAmelia Natasha Daniel Mananta Soo Kui JienJuri Anu MalikIndra Lesmana Paul Moss Pilita Corrales Ken Lim Siu BlackJmlh. episode5ProduksiProduserSandra FulloonLokasi produksiJakarta International Expo, Kemayoran, Jakarta Utara, IndonesiaRilisJaringan asliRCTIRilis asli24 November –16 Desember 2007 Asian Idol adalah sebuah kompetisi menyanyi realitas, yang menampilkan pemenang kompetisi Idol dari enam negara Asia Tenggara dan Selatan diantaranya India...

Varianti esistenti: Lu Uaste (Abbruzzese) - Artículo scritto in napulitano Vasto Nomme ufficiale: Vasto Stato: Italia Reggione: Abruzzo Pruvincia: 'e Chiete Estenzione: 70,65 km² Pupulazzione: 39.280 (30/06/2012) Denzità: 0,56 ab./km² 'E riune: Sant'Antonio, Incoronata, Lebba, Pagliarelli, Vasto Marina, San Biagio Commune vicini: Casalbordino, Cupello, Monteodorisio, Pollutri, San Salvo Coordinate giugrafiche: 42°6′41.72″N 14°42′29.59″E Sinnaco: {{{sinnaco}}} Codice pustale:...

هذه المقالة يتيمة إذ تصل إليها مقالات أخرى قليلة جدًا. فضلًا، ساعد بإضافة وصلة إليها في مقالات متعلقة بها. (يونيو 2023) هربرت فيفيان معلومات شخصية تاريخ الميلاد 3 أبريل 1865[1][2] تاريخ الوفاة 18 أبريل 1940 (75 سنة) [1][2] الحياة العملية المدرسة الأم كلية الثالوث

De Duitse Keizerin Victoria met de huisorde van haar ouders en de Luisen-Orde van Pruisen De vier graden van de Orde. De Koninklijke Victoria en Albert-Orde (Engels: Royal Order of Victoria and Albert) was de Koninklijke Familieorde die door de Britse koningin Victoria sinds 1862 werd uitgereikt. Iedere monarch sinds George IV verleende aan de dames van het hof in diamanten gevatte en op ivoor geschilderde miniatuurportretten van zichzelf. Koningin Victoria, die haar echtgenoot, de prins-gema...

Island in Papua New Guinea NormanbyTopographic map of Normanby IslandNormanbyGeographyCoordinates10°S 151°E / 10°S 151°E / -10; 151ArchipelagoD'Entrecasteaux IslandsArea1,000 km2 (390 sq mi)Highest elevation1,158 m (3799 ft)Highest pointPrevost RangeAdministrationPapua New GuineaProvinceMilne Bay ProvinceLargest settlementEsa’ala Normanby Island is a volcanic 1,000-square-kilometre (390 sq mi), L-shaped and mountainous...

Slotted medium access control protocol widely used in ad hoc networks Multiple Access with Collision Avoidance for Wireless (MACAW)[1] is a slotted medium access control (MAC) protocol widely used in ad hoc networks.[2] Furthermore, it is the foundation of many other MAC protocols used in wireless sensor networks (WSN).[2] The IEEE 802.11 RTS/CTS mechanism is adopted from this protocol.[3][4] It uses RTS-CTS-DS-DATA-ACK frame sequence for transferring d...

American academic administrator For the member of the Missouri House of Representatives, see Randy D. Dunn. This article uses bare URLs, which are uninformative and vulnerable to link rot. Please consider converting them to full citations to ensure the article remains verifiable and maintains a consistent citation style. Several templates and tools are available to assist in formatting, such as reFill (documentation) and Citation bot (documentation). (August 2022) (Learn how and when to remov...

2022 Indian mystery film For the 2017 Norwegian film set in World War II, see The 12th Man (film). 12th ManPosterDirected byJeethu JosephWritten byK. R. Krishna KumarStory bySunir KhetarpalProduced byAntony PerumbavoorStarringMohanlalCinematographySatheesh KurupEdited byV. S. VinayakMusic byAnil JohnsonProductioncompanyAashirvad CinemasDistributed byDisney+ HotstarRelease date 20 May 2022 (2022-05-20) Running time163 minutesCountryIndiaLanguageMalayalam 12th Man is a 2022 India...

Plasmid miniprep. 0.8% agarose gel ethidium bromide-stained. A plasmid preparation is a method of DNA extraction and purification for plasmid DNA, it is an important step in many molecular biology experiments and is essential for the successful use of plasmids in research and biotechnology.[1][2] Many methods have been developed to purify plasmid DNA from bacteria.[1][3] During the purification procedure, the plasmid DNA is often separated from contaminating pr...

Edward Sheldon in 1914 Romance is a play by the American dramatist Edward Sheldon. It was first produced in New York in 1913, and a London production followed in 1915, which ran for 1,049 performances. Both productions featured Doris Keane as an opera star who has an intense affair with a young clergyman. Performance history William Courtenay in 1909 The play opened at the Maxine Elliott Theatre, New York, on February 10, 1913. It featured Doris Keane as Mme Margherita Cavallini, William Cour...

Polish satirical comedy television series 1670Polish Netflix posterGenre Satirical comedy Black comedy Written byJakub RużyłłoDirected by Maciej Buchwald Kordian Kądziela Starring Bartłomiej Topa Katarzyna Herman Martyna Byczkowska Michał Balicki Michał Sikorski Kirył Pietruczuk Dobromir Dymecki Country of originPolandOriginal languagePolishProductionProducers Ivo Krankowski Jan Kwieciński CinematographyNils CronéProduction companyAkson StudioOriginal releaseNetworkNetflixRelease13&...

Charles M. SchulzCharles M. Schulz pada tahun 1956, menggambar Charlie BrownNama lahirCharles Monroe SchulzLahir26 November 1922 (umur 101)Minneapolis, Minnesota, Amerika SerikatMeninggal12 Februari 2000(2000-02-12) (umur 77)Santa Rosa, California, Amerika SerikatDinas/cabangAngkatan Darat Amerika SerikatLama dinas1943-1946PangkatSersan StafKesatuan Divisi Lapis Baja ke-20Perang/pertempuranPerang Dunia IIPenghargaan Combat Infantryman Badge Wo...

LumadSuku Manobo dengan pakaian adat pada Festival Kaamulan di Bukidnon.Jumlah populasiTidak diketahuiDaerah dengan populasi signifikan Filipina Caraga Region Davao Mindanao Utara Soccsksargen Semenanjung ZamboangaBahasaManobo, Chavacano (di Zamboanga), Cebuano, Hiligaynon, Filipino, InggrisAgamaKekristenan (Katolik Roma, Protestanisme) dan AnimismeKelompok etnik terkaitBajau, Moro, Bisaya Lumad (secara harfiah: pribumi) adalah kelompok masyarakat adat Austronesia asli Pulau Mindanao di ...

SMA Negeri 54 JakartaInformasiDidirikan1979JenisNegeriAkreditasiAKepala SekolahRustaman, S.PdJumlah kelas8 kelas setiap tingkatJurusan atau peminatanIPA dan IPSRentang kelasX IPA, X IPS, XI IPA, XI IPS, XII IPA, XII IPSKurikulumKurikulum Tingkat Satuan PendidikanJumlah siswa960 siswa (40 siswa per kelas)StatusSekolah penyelenggara program inklusiAlamatLokasiJl. Jatinegara Timur IV No.8, RT.8/RW.7, Kelurahan Rawa Bunga, Kecamatan Jatinegara, Kota Jakarta Timur, Daerah Khusus Ibu...

National Rail station in London, England St Mary Cray St Mary CrayLocation of St Mary Cray in Greater LondonLocationSt Mary CrayLocal authorityLondon Borough of BromleyManaged bySoutheasternStation codeSMYDfT categoryC2Number of platforms4Fare zone6National Rail annual entry and exit2017–18 1.803 million[1]2018–19 1.787 million[1]2019–20 1.670 million[1]2020–21 0.520 million[1]2021–22 1.064 million[1]Key dates3 December 1860Opened1959rebuilt a...

علي بن فضال المجاشعي التميمي معلومات شخصية الميلاد 404 هـ / 1013مهجر، الدولة العباسية الوفاة 479 هـ / 1087م (75 سنة)بغداد، الدولة السلجوقية العرق عرب الديانة الإسلام، أهل السنة والجماعة الحياة العملية المهنة عالم مسلم، ولغوي، وشاعر، وأديب اللغات العربية تعد�...

Tehsil in Maharashtra, IndiaAkole talukaTehsilLocation of Akole in Ahmednagar district in MaharashtraCoordinates: 19°32′32.06″N 74°0′19.88″E / 19.5422389°N 74.0055222°E / 19.5422389; 74.0055222Country IndiaStateMaharashtraDistrictAhmednagar districtHeadquartersAkoleGovernment • Lok Sabha constituencyShirdi (Lok Sabha constituency) • Assembly constituencyAkole (Vidhan Sabha constituency) • MLADr. Kiran Yamaji Lahamate...

У этого термина существуют и другие значения, см. Трансформатор (значения). Эле́ктротрансформа́тор, в разговорной речи чаще просто трансформа́тор (от лат. transformare — «превращать, преобразовывать») — статическое электромагнитное устройство, имеющее две или более и...

South African-born novelist Tarryn FisherBornc. 1983[1]Johannesburg, South AfricaOccupationNovelistNotable workThe WivesThe Wrong Family Tarryn Fisher (born 1983) is a South African-born novelist based in Seattle, Washington, United States.[2] She writes primarily in the romance, thriller, and new adult genres, and is best known for her New York Times best selling novels The Wives and The Wrong Family.[3][4] Early life and career Tarryn Fisher was born in...

Historic house in Virginia, United States United States historic placeFranklin and Armfield OfficeU.S. National Register of Historic PlacesU.S. National Historic LandmarkVirginia Landmarks Register Freedom House in 2022Show map of Alexandria Historical DistrictShow map of Northern VirginiaShow map of VirginiaShow map of the United StatesLocation1315 Duke Street,Alexandria, VirginiaCoordinates38°48′14″N 77°3′17″W / 38.80389°N 77.05472°W / 38.80389; -77.05472...