| 2-Méthyltétrahydrofurane
|

|
 |
Structure moléculaire du 2-méthyltétrahydrofurane (en haut).
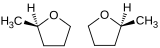
Énantiomère R du 2-méthyltétrahydrofurane (à gauche) et S-2-méthyltétrahydrofurane (à droite). |
| Identification |
| Nom UICPA
|
2-méthyloxolane
|
| No CAS
|
96-47-9 (RS)
63798-13-0 ((R)-(–))
63798-12-9 ((S)-(+))
|
| No ECHA
|
100.002.281 |
| No CE
|
202-507-4
|
| No RTECS
|
LU2800000
|
| PubChem
|
7301
|
| SMILES
|
|
| InChI
|
InChI : vue 3D InChI=1S/C5H10O/c1-5-3-2-4-6-5/h5H,2-4H2,1H3 InChIKey : JWUJQDFVADABEY-UHFFFAOYSA-N |
| Apparence
|
liquide[1] incolore avec une odeur d'éther[2]
|
| Propriétés chimiques |
| Formule
|
C5H10O [Isomères]
|
| Masse molaire[3]
|
86,132 3 ± 0,005 g/mol
C 69,72 %, H 11,7 %, O 18,58 %,
|
| Moment dipolaire
|
D
|
| Diamètre moléculaire
|
nm
|
| Propriétés physiques |
| T° fusion
|
−136 °C[2]
|
| T° ébullition
|
78 à 80 °C[4]
|
| Masse volumique
|
0,86 g cm−3 à 25 °C[4]
|
| T° d'auto-inflammation
|
270 °C[2]
|
| Point d’éclair
|
−11 °C[2],[4]
|
| Viscosité dynamique
|
4 mPa s à 25 °C[2]
|
| Propriétés optiques |
| Indice de réfraction
|
 =1,406[4] =1,406[4]
|
| Précautions |
| SGH[4],[2] |
H225, H319, H335, P210, P233, P243 et P305+P351+P338H225 : Liquide et vapeurs très inflammables
H319 : Provoque une sévère irritation des yeux
H335 : Peut irriter les voies respiratoires
P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer.
P233 : Maintenir le récipient fermé de manière étanche.
P243 : Prendre des mesures de précaution contre les décharges électrostatiques.
P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer.
|
| Transport[1] |
Numéro ONU :2536 : MÉTHYLTÉTRAHYDROFURANNE Classe :3 Code de classification :Code non reconnu : II. Signaler une erreur : Discussion_Modèle:ADRÉtiquette : 3 3 : Liquides inflammables |
| Écotoxicologie |
| DL50
|
4 500 mg/kg (lapin, cutané)[5]
6 000 ppm/4 h (rat, inhalation)[5]
|
|
| Unités du SI et CNTP, sauf indication contraire. |
modifier  |
Le 2-méthyltétrahydrofurane est un composé organique de formule CH3C4H7O. C'est un solvant inflammable notamment utilisé en remplacement du tétrahydrofurane (THF). Il peut être également utilisé comme carburant.
Stéréochimie
Le 2-méthyltétrahydrofurane est chiral, possédant un centre stéréogène qui porte le substituant méthyle ; il existe donc sous la forme de deux énantiomères :
Préparation
Le 2-méthyltétrahydrofurane est principalement synthétisé par hydrogénation catalytique du furfural.
OC4H3CHO + 4 H2 → OC4H7CH3 + H2O
Il peut être également produit à partir de l'acide lévulinique. Une première étape consiste en une cyclisation suivie d'une réduction en γ-valérolactone.
La lactone est ensuite hydrogénée en 1,4-pentandiol qui est déshydraté pour former le 2-méthyltétrahydrofurane.
Utilisations
Le 2-méthyltétrahydrofurane est principalement utilisé comme solvant pour remplacer le THF à cause de son point d'ébullition plus élevé. Néanmoins il peut, comme ce dernier, former des peroxydes dangereux, ce qui peut être aussi évité par adjonction d'un inhibiteur et antioxydant puissant[1],[4], le 2,6-di-tertiobutyl-4-méthylphénol (DTBMP) improprement dénommé « hydroxytoluène butylé »[6].
Notes et références
- ↑ a b et c PubChem CID 7301.
- ↑ a b c d e et f Entrée « 2-Methyl tetrahydrofuran anhydrous » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27/06/2015 (JavaScript nécessaire).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c d e et f Fiche Sigma-Aldrich du composé 2-Methyltetrahydrofuran anhydrous, ≥99%, Inhibitor-free, consultée le 27 juin 29015.
- ↑ a et b (en) « 2-Méthyltétrahydrofurane », sur ChemIDplus.
- ↑ Appellation (provenant d'une traduction mot à mot du sigle anglo-saxon BHT, butylated hydroxytoluene) fautive puisque ne précisant ni le nombre ni le caractère tertiaire du radical butyle et oubliant que le substituant prioritaire du noyau benzénique est l'hydroxyle (-OH) et non le méthyle (-CH3), d'où la dénomination correcte de « phénol » et non de toluène et encore moins de crésol.