 ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ ЫҢШ§ ШЁЩҮ Ш№ШЁШ§ШұШӘ ШіШ§ШҜЩҮвҖҢШӘШұ ЪҳЫҢШұШ§ШІШҢ ШўЩҶШІЫҢЩ…ЫҢ Ш§ШіШӘ Ш§ШІ ШҜШіШӘЩҮЩ” ШӘЩҲЩҫЩҲШ§ЫҢШІЩҲЩ…ШұШ§ШІЩҮШ§ Ъ©ЩҮ Щ…ШұШЁЩҲШ· ШЁЩҮ ШІЫҢШұШҜШіШӘЩҮЩ” ШҜЩҲЩ… ШўЩҶвҖҢЩҮШ§ Ш§ШіШӘ Ъ©ЩҮ ШҜШұ ЩҒШұШ§ЫҢЩҶШҜЩҮШ§ЫҢ ШҜШ§Ш®Щ„ ШіЩ„ЩҲЩ„ЫҢ Щ…Ш§ЩҶЩҶШҜ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЫҢШ§ ШұЩҲЩҶЩҲЫҢШіЫҢ Ш§ШІ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩҶЩӮШҙ ШҜШ§ШұШҜ.[Ыұ] Ш§ЫҢЩҶ ШўЩҶШІЫҢЩ… ШҜШұ ЫҢЪ© ЩҒШұШ§ЫҢЩҶШҜ ЩҲШ§ШЁШіШӘЩҮ ШЁЩҮ Ш§ЩҶШұЪҳЫҢ ШўШҜЩҶЩҲШІЫҢЩҶ ШӘШұЫҢвҖҢЩҒШіЩҒШ§ШӘ (ATP) ЩҮЩҶЪҜШ§Щ…ЫҢ Ъ©ЩҮ ШўШұШ§ЩҶвҖҢШ§ЫҢ ЩҫЩ„ЫҢвҖҢЩ…ШұШ§ШІ ЫҢШ§ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩҮЩ„ЫҢЪ©Ш§ШІ ШҜШұ ШӯШ§Щ„ ШЁШ§ШІЪ©ШұШҜЩҶ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШҜЩҲ ШұШҙШӘЩҮвҖҢШ§ЫҢ ШҜШұ ЩҶШ§ШӯЫҢЩҮвҖҢЩҮШ§ЫҢ Щ…Ш®ШөЩҲШө ШЁШұШ§ЫҢ ШҙШұЩҲШ№ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ ШЁЩҮ ЩҶШ§Щ… Щ…Ъ©Ш§ЩҶ ШўШәШ§ШІШҙ ЩҮЩ…ШӘШ§ШіШ§ШІЫҢ ЩҮШіШӘЩҶШҜШҢ ШҜШұ ЩҫШҙШӘ ШўЩҶвҖҢЩҮШ§ ШұЩҲЫҢ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩӮШұШ§Шұ Щ…ЫҢвҖҢЪҜЫҢШұШҜ ЩҲ ШЁШ§Ш№Ш« Ъ©Ш§ЩҮШҙ ЩҫЫҢЪҶ ЩҲ ШӘШ§ШЁ Ш®ЩҲШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ ЩӮШіЩ…ШӘвҖҢЩҮШ§ЫҢЫҢ Ш§ШІ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ъ©ЩҮ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ Ш§ШІ ШұЩҲЫҢ ШўЩҶвҖҢЩҮШ§ ШЁЩҮ ЩҫШ§ЫҢШ§ЩҶ ШұШіЫҢШҜЩҮвҖҢШ§ШіШӘ Щ…ЫҢвҖҢШҙЩҲШҜ.[ЫІ][Ыі] Ш§ЫҢЩҶ ШўЩҶШІЫҢЩ… ШҜШұ ЩҲШ§ЩӮШ№ ЩҲШёЫҢЩҒЩҮ ШҜШ§ШұШҜ ШӘШ§ ШЁШ§ ЩҒШҙШұШҜЩҮвҖҢШіШ§ШІЫҢ ЩҲ ЩҫЫҢЪҶвҖҢЩҲШӘШ§ШЁ ШҜШ§ШҜЩҶ ШЁЩҮ ШұШҙШӘЩҮЩ” ШЁЩ„ЩҶШҜ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢШҢ ШўЩҶ ШұШ§ ШҜШұ ЩҒШ¶Ш§ЫҢ Ъ©ЩҲЪҶЪ© ЩҮШіШӘЩҮ Ш¬Ш§ Ъ©ЩҶШҜ Ъ©ЩҮ Ш§ЫҢЩҶ Ъ©Ш§Шұ ШұШ§ ШЁШ§ Ш§ЫҢШ¬Ш§ШҜ Ъ©ШұШҜЩҶ ЩҒШҙШұШҜЩҮвҖҢШіШ§ШІЫҢвҖҢЩҮШ§ЫҢ Щ…ЩҶЩҒЫҢ ЫҢШ§ ШЁЩҮ Ш№ШЁШ§ШұШӘ ШҜЫҢЪҜШұ ШЁШ§ ШўШІШ§ШҜШіШ§ШІЫҢ ЩҒШҙШұШҜЩҮвҖҢШҙШҜЪҜЫҢвҖҢЩҮШ§ЫҢ Щ…Ш«ШЁШӘ Ш§ЩҶШ¬Ш§Щ… Щ…ЫҢвҖҢШҜЩҮШҜ. Ш§ЫҢЩҶ ЩҒШұШ§ЫҢЩҶШҜ ЩҒШҙШұШҜЩҮвҖҢШіШ§ШІЫҢ ШҜШұ ШіЩ„ЩҲЩ„вҖҢЩҮШ§ЫҢ ЩҫШұЩҲЪ©Ш§ШұЫҢЩҲШӘЩҮШ§ ШЁЩҮ Ш®ШөЩҲШө ШЁШ§Ъ©ШӘШұЫҢвҖҢЩҮШ§ Ш§ШӘЩҒШ§ЩӮ Щ…ЫҢвҖҢШ§ЩҒШӘШҜ ШІЫҢШұШ§ Ъ©ЩҮ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ш§ЫҢЩҶ Щ…ЩҲШ¬ЩҲШҜШ§ШӘ ШЁЩҮ ШөЩҲШұШӘ ЫҢЪ© ШӯЩ„ЩӮЩҮ ШҜШ§ЫҢШұЩҮвҖҢШ§ЫҢ Ш§ШіШӘ ЩҲ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ ШЁШ§ ЩӮШ·Ш№ Ъ©ШұШҜЩҶ Ш§ЫҢЩҶ ШұШҙШӘЩҮ ШҜШ§ЫҢШұЩҮвҖҢШ§ЫҢШҢ ЩҒШҙШұШҜЩҮвҖҢШіШ§ШІЫҢ Ъ©ЩҮ ШЁШ§Ш№Ш« ШӘШәЫҢЫҢШұ ШҜШұ ШӘШ№ШҜШ§ШҜ ЩҫЫҢЪҶвҖҢЩҲШӘШ§ШЁвҖҢЩҮШ§ЫҢ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Щ…ЫҢвҖҢШҙЩҲШҜ ШұШ§ Ш§ЩҶШ¬Ш§Щ… Щ…ЫҢвҖҢШҜЩҮШҜ ЩҲ ШҜШұ Ш§ЩҶШӘЩҮШ§ЫҢ Ъ©Ш§Шұ ШҜЩҲ ШіШұ Ш¬ШҜШ§ Ш§ШІ ЩҮЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШұШ§ ШЁЩҮ ЩҮЩ… Щ…ЫҢвҖҢЩҫЫҢЪҶШ§ЩҶШҜ. Ш§ЫҢЩҶ Ш®Ш§ШөЫҢШӘ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ Ъ©ЩҮ ШЁШ§Ш№Ш« ШЁЩҮ ЩҲШ¬ЩҲШҜ ШўЩ…ШҜЩҶ ЩҒШҙШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ Щ…ЩҶЩҒЫҢ ЫҢШ§ ШӘШЁШҜЫҢЩ„ Ъ©ШұШҜЩҶ ЩҒШҙШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ Щ…Ш«ШЁШӘ ШЁЩҮ Щ…ЩҶЩҒЫҢ Ш§ШіШӘШҢ Ш§ЫҢЩҶ Ш§Ш¬Ш§ШІЩҮ ШұШ§ ШЁЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢвҖҢЫҢ ШЁШ§Ъ©ШӘШұЫҢ Щ…ЫҢвҖҢШҜЩҮШҜ Ъ©ЩҮ ШЁЩҮ ШіШ§ШҜЪҜЫҢ Ш§ШІ ШұЩҲЫҢ ШўЩҶ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ ЩҲ ШұЩҲЩҶЩҲЫҢШіЫҢ Ш§ЩҶШ¬Ш§Щ… ШҙЩҲШҜ ШІЫҢШұШ§ Ъ©ЩҮ ШЁЩҮ ШөЩҲШұШӘ Ш·ШЁЫҢШ№ЫҢ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩҫЫҢЪҶШҙвҖҢЩҮШ§ЫҢ Щ…Ш«ШЁШӘ ЩҫЫҢШҜШ§ Щ…ЫҢвҖҢЪ©ЩҶШҜШҢ ШӯШ§Щ„ Ш§ЫҢЩҶ ШўЩҶШІЫҢЩ… Ш¬Щ„ЩҲЫҢ Ш§ЫҢЩҶ Ш§Щ…Шұ ШұШ§ Щ…ЫҢвҖҢЪҜЫҢШұШҜ ЩҲ Ш§Щ…Ъ©Ш§ЩҶ Ш¬Щ„ЩҲ ШұЩҒШӘЩҶ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩҮЩ„ЫҢЪ©Ш§ШІ ШЁШұ ШұЩҲЫҢ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЩҒШұШ§ЩҮЩ… Щ…ЫҢвҖҢШіШ§ШІШҜ ШӘШ§ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ ЫҢШ§Щ„ ШұЩҲЩҶЩҲЫҢШіЫҢ ШЁЩҮ ШөЩҲШұШӘ Ъ©Ш§Щ…Щ„ ШӘЪ©Щ…ЫҢЩ„ ШҙЩҲШҜ. ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ ШәШ§Щ„ШЁШ§ЩӢ ШҜШұ Ъ©Щ„ШұЩҲЩҫЩ„Ш§ШіШӘ ЪҜЫҢШ§ЩҮШ§ЩҶ Щ…Ш®ШӘЩ„ЩҒ ЫҢШ§ЩҒШӘ Щ…ЫҢвҖҢШҙЩҲШҜ.[Ыұ][Ыҙ]
ЩҶЩ…ЩҲЩҶЩҮЩ” ШЁШ§Ъ©ШӘШұЫҢШ§ЫҢЫҢ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ ЩҮШҜЩҒ ЩҶШ§ШЁЩҲШҜШіШ§ШІЫҢ ШЁШіЫҢШ§ШұЫҢ Ш§ШІ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ Ш§ШІ Ш¬Щ…Щ„ЩҮ Ш§ШіЫҢШҜ ЩҶШ§Щ„ЫҢШҜЫҢЪ©ШіЫҢЪ©ШҢ ЩҶЩҲЩҲШЁЫҢЩҲШіЫҢЩҶ ЩҲ ШіЫҢЩҫШұЩҲЩҒЩ„ЩҲЪ©ШіШ§ШіЫҢЩҶ Ш§ШіШӘ.
 ЩҒШҙШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ (supercoilings) Щ…Ш«ШЁШӘ ЩҲ Щ…ЩҶЩҒЫҢ ШЁШұ ШұЩҲЫҢ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШЁШ§Ъ©ШӘШұЫҢ euk topo 1
ЩҒШҙШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ (supercoilings) Щ…Ш«ШЁШӘ ЩҲ Щ…ЩҶЩҒЫҢ ШЁШұ ШұЩҲЫҢ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШЁШ§Ъ©ШӘШұЫҢ euk topo 1
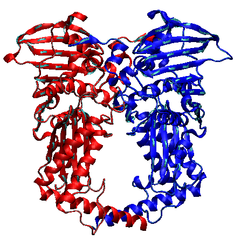
ШіШ§Ш®ШӘШ§Шұ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
 ЩҶЩ…Ш§ЫҢЫҢ Ш§ШІ ШіШ§Ш®ШӘШ§Шұ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ЩҶЩ…Ш§ЫҢЫҢ Ш§ШІ ШіШ§Ш®ШӘШ§Шұ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ Ш§ШІ ШҜШіШӘЩҮ ШўЩҶШІЫҢЩ…вҖҢЩҮШ§ЫҢ ШӘШӘШұШ§Щ…ШӘШұЫҢЪ© Ш§ШіШӘШӣ ШЁШҜЫҢЩҶ Щ…Ш№ЩҶШ§ Ъ©ЩҮ ШіШ§Ш®ШӘШ§Шұ ШўЩҶ Ш§ШІ Ыҙ ШЁШ®Шҙ ЪҜЩҲЩҶШ§ЪҜЩҲЩҶ ШӘШҙЪ©ЫҢЩ„ ШҙШҜЩҮвҖҢШ§ШіШӘ. Ш§ЫҢЩҶ ШіШ§Ш®ШӘШ§Шұ ШҙШ§Щ…Щ„ ШҜЩҲ ШЁШ®Шҙ GyrA (ЫҢШ§ ШІЫҢШұШЁШ®ШҙвҖҢЩҮШ§ЫҢ A) ЩҲ ШҜЩҲ ШЁШ®Шҙ GryB (ЫҢШ§ ШІЫҢШұШЁШ®ШҙвҖҢЩҮШ§ЫҢ B) Ш§ШіШӘ.
ШіШ§Ш®ШӘШ§Шұ ЩҫЫҢЪҶЫҢШҜЩҮЩ” ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ Щ…Ш®Щ„ЩҲШ·ЫҢ Ш§ШІ ШіЩҮ Ш¬ЩҒШӘ ШҜШұЫҢЪҶЩҮ(gate) ШЁЩҮ ЩҶШ§Щ…вҖҢЩҮШ§ N-gates, C-gates ЩҲ DNA-gatesШҢ ЩҶЩҲШ§ШӯЫҢ ЩҲШұЩҲШҜЫҢ ЩҲ Ш®ШұЩҲШ¬ЫҢ Ъ©ЩҮ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШҜШұ ЩҒШ§ШөЩ„ЩҮЩ” ШЁЫҢЩҶ ШўЩҶвҖҢЩҮШ§ Щ…ЩҶШӘЩӮЩ„ Щ…ЫҢвҖҢШҙЩҲШҜ ЩҲ ЩҶШ§ШӯЫҢЩҮвҖҢШ§ЫҢ Ъ©ЩҮ ЩҒШҙШұШҜЪҜЫҢвҖҢЩҮШ§ЫҢ Щ…ЩҶЩҒЫҢ ШҜШұ ШўЩҶ ШЁЩҮ ЩҲШ¬ЩҲШҜ Щ…ЫҢвҖҢШўЫҢЩҶШҜ. ШҜШұЫҢЪҶЩҮвҖҢЩҮШ§ЫҢ N-gates ШӘЩҲШіШ· ШЁШ®Шҙ GyrB ШіШ§Ш®ШӘЩҮ ШҙШҜЩҮвҖҢШ§ЩҶШҜ ЩҲ ШЁШ§ Щ…ШӘШөЩ„ ШҙШҜЩҶ ШҜЩҲ Щ…ЩҲЩ„Ъ©ЩҲЩ„ ATP ШЁЩҮ ШўЩҶвҖҢЩҮШ§ ЩҲ ШҜШұ ЩҶШӘЫҢШ¬ЩҮ ШўШІШ§ШҜ Ъ©ШұШҜЩҶ Ш§ЩҶШұЪҳЫҢШҢ ШЁШ§Ш№Ш« ШҙШұЩҲШ№ ШҙШҜЩҶ ЩҒШұШ§ЫҢЩҶШҜЩҮШ§ЫҢ ШЁЫҢЩҶ ШўЩҶШІЫҢЩ… ЩҲ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ъ©ЩҮ ШЁЩҮ ШўЩҶ Щ…ШӘШөЩ„ ШҙШҜЩҮ Щ…ЫҢвҖҢШҙЩҲЩҶШҜ. ЩҒШұШ§ЫҢЩҶШҜ ЩҮЫҢШҜШұЩҲЩ„ЫҢШІ ШҜШұ Ш¬ЩҮШӘ Ш№Ъ©Ші ШЁШ§Ш№Ш« ШЁШіШӘЩҮ ШҙШҜЩҶ ШҜШұЫҢЪҶЩҮвҖҢЩҮШ§ Щ…ЫҢвҖҢШҙЩҲШҜ. ШҙЪ©Ш§ЩҒШӘЩҮ ШҙШҜЩҶ ЩҲ ШЁШіШӘЩҮ ШҙШҜЩҶ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ъ©ЩҮ ШӯШ§ШөЩ„ ЫҢЪ© ШіШұЫҢ ЩҒШұШ§ЫҢЩҶШҜЩҮШ§ЫҢ Ъ©Ш§ШӘШ§Щ„ЫҢШіШӘЫҢ Ш§ШіШӘ Ъ©ЩҮ ШҜШұ DNA-gates Ш§ШӘЩҒШ§ЩӮ Щ…ЫҢвҖҢШ§ЩҒШӘШҜШҢ Ш§ЫҢЩҶ ШҜШұЫҢЪҶЩҮвҖҢЩҮШ§ Ш§ШІ ЩҮЩ…ЩҮЩ” ШЁШ®ШҙвҖҢЩҮШ§ЫҢ Ъ©Щ„ ШўЩҶШІЫҢЩ… ШӘШҙЪ©ЫҢЩ„ ШҙШҜЩҮвҖҢШ§ЩҶШҜ ЫҢШ№ЩҶЫҢ GyrA ЩҲ GyrB. ШҜШұЫҢЪҶЩҮвҖҢЩҮШ§ЫҢ C-gates Ш§ШІ ЩӮШіЩ…ШӘвҖҢЩҮШ§ЫҢ GyrA ШўЩҶШІЫҢЩ… ШіШ§Ш®ШӘЩҮ ШҙШҜЩҮвҖҢШ§ЩҶШҜ.[Ыө]
ЩҶШӯЩҲЩҮЩ” Ш№Щ…Щ„вҖҢЪ©ШұШҜЩҶ ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ
 ЪҶШұШ®ЩҮЩ” Ш№Щ…Щ„Ъ©ШұШҜ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ЪҶШұШ®ЩҮЩ” Ш№Щ…Щ„Ъ©ШұШҜ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ
ШҜШұ ЩҮЩҶЪҜШ§Щ…ЫҢ Ъ©ЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ ШЁЩҮ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Щ…ШӘШөЩ„ Щ…ЫҢвҖҢШҙЩҲШҜШҢ ЩҮЩ…Ш§ЩҶвҖҢШ·ЩҲШұ Ъ©ЩҮ ШҜШұ ЩӮШіЩ…ШӘ ЩӮШЁЩ„ ШЁЩҮ ШўЩҶ Ш§ШҙШ§ШұЩҮ Ъ©ШұШҜЫҢЩ… ШҜЩҲ Щ…ЩҲЩ„Ъ©ЩҲЩ„ ATP Ъ©ЩҮ ШҙШ§Щ…Щ„ ШЁШіШӘЩҮвҖҢЩҮШ§ЫҢ Ш§ЩҶШұЪҳЫҢ ЩҮШіШӘЩҶШҜ ШЁЩҮ ШіШ§Ш®ШӘШ§Шұ ШўЩҶШІЫҢЩ… Щ…ЫҢвҖҢЪҶШіШЁЩҶШҜ ЩҲ ШЁШ§Ш№Ш« ШӘШәЫҢЫҢШұ ШҙЪ©Щ„ ШҜШұ ЩӮШіЩ…ШӘ GyrB ШҙШҜЩҮ ЩҲ ШҜШұ ЩҶШӘЫҢШ¬ЩҮ ЩӮШіЩ…ШӘ Ш¬Ш§ШЁЩҮвҖҢШ¬Ш§ ШҙЩҲЩҶШҜЩҮЩ” ШұШҙШӘЩҮ DNA ШҜШұ ШЁЫҢЩҶ ШІЫҢШұШЁШ®ШҙвҖҢЩҮШ§ЫҢ ЩӮШіЩ…ШӘ GyrB ШўЩҶШІЫҢЩ… ЩӮШұШ§Шұ Щ…ЫҢвҖҢЪҜЫҢШұШҜ. ШҜШұ Щ…ШұШӯЩ„ЩҮ ШЁШ№ШҜ ЩӮШіЩ…ШӘ gate-segment ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ (ШҜШұ ШҙЪ©Щ„ ЩҶШҙШ§ЩҶ ШҜШ§ШҜЩҮ ШҙШҜЩҮвҖҢШ§ШіШӘ) ШҜШұ DNA-gates ШўЩҶШІЫҢЩ… ЩӮШұШ§Шұ Щ…ЫҢвҖҢЪҜЫҢШұШҜ ЩҲ Ъ©ЩҮ ШЁШ§Ш№Ш« ЩҫШ§ШұЩҮвҖҢШҙШҜЩҶ ЩҮШұ ШҜЩҲ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Щ…ЫҢвҖҢШҙЩҲШҜ. ШіЩҫШі ШЁШ§ ЩҮЫҢШҜШұЩҲЩ„ЫҢШІЩҮ ШҙШҜЩҶ ЫҢЪ©ЫҢ Ш§ШІ Щ…ЩҲЩ„Ъ©ЩҲЩ„вҖҢЩҮШ§ЫҢ ATP Щ…ШӘШөЩ„ ШҙШҜЩҮШҢ ЩӮШіЩ…ШӘ Ш¬Ш§ШЁЩҮвҖҢШ¬Ш§ ШҙЩҲЩҶШҜЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ (ШҜШұ ШҙЪ©Щ„ ШЁШ§ Ш№ЩҶЩҲШ§ЩҶ T-segment ЩҶЩ…Ш§ЫҢШҙ ШҜШ§ШҜЩҮ ШҙШҜЩҮвҖҢШ§ШіШӘ) Ш§ШІ ШЁЫҢЩҶ T-segment Ъ©ЩҮ ЪҜШіШіШӘЩҮ ШҙШҜЩҮвҖҢШ§ШіШӘШҢ Ш№ШЁЩҲШұ Щ…ЫҢвҖҢЪ©ЩҶШҜ. ШҜШұ Ш§ЩҶШӘЩҮШ§ ШўЩҶШІЫҢЩ… ЩҶШ§ШӯЫҢЩҮЩ” ЩҫШ§ШұЩҮ ШҙШҜЩҮЩ” ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЫҢШ№ЩҶЫҢ G-segment ШұШ§ ЩҫЫҢЩҲЩҶШҜ Щ…ЫҢвҖҢШІЩҶШҜ ЩҲ ШҜШұ Ш§ЩҶШӘЩҮШ§ T-segment Ш§ШІ ШіШ§Ш®ШӘЩ…Ш§ЩҶ ШўЩҶШІЫҢЩ… ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ЪҳЫҢШұШ§ШІ Ш®Ш§ШұШ¬ Щ…ЫҢвҖҢШҙЩҲШҜ. ШЁШ§ ЩҮЫҢШҜШұЩҲЩ„ЫҢШІЩҮ ШҙШҜЩҶ Щ…ЩҲЩ„Ъ©ЩҲЩ„ ATP ШҜЩҲЩ…ШҢ ШіШ§Ш®ШӘШ§Шұ ШўЩҶШІЫҢЩ… ШЁЩҮ ШӯШ§Щ„ШӘ Ш§ЩҲЩ„ЫҢЩҮЩ” Ш®ЩҲШҜ ШЁШ§ШІЩ…ЫҢвҖҢЪҜШұШҜШҜ.[Ы¶]
ШҜШұ ЩҶШӘЫҢШ¬ЩҮ ШҜШұ ЩҮШұ ЪҶШұШ®ЩҮ Ъ©Ш§ШӘШ§Щ„ЫҢШіШӘЫҢ Ъ©ЩҮ ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ Ш·ЫҢ Щ…ЫҢвҖҢЪ©ЩҶШҜШҢ ШҜЩҲ Щ…ЩҲЩ„Ъ©ЩҲЩ„ ATP ЩҮЫҢШҜШұЩҲЩ„ЫҢШІ Щ…ЫҢвҖҢШҙЩҲЩҶШҜ ЩҲ ШҜЩҲ ЩҒШҙШұШҜЪҜЫҢ Щ…ЩҶЩҒЫҢ ШЁЩҮ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ъ©ЩҮ ЩҒШұШ§ЫҢЩҶШҜ ШЁШұ ШұЩҲЫҢ ШўЩҶ Ш§ЩҶШ¬Ш§Щ… ШҙШҜЩҮвҖҢШ§ШіШӘШҢ Ш§Ш¶Ш§ЩҒЩҮ Щ…ЫҢвҖҢШҙЩҲШҜ. ШЁШұ Ш§ШіШ§Ші Щ…ШҙШ§ЩҮШҜШ§ШӘ Щ…ЫҢвҖҢШӘЩҲШ§ЩҶ ШЁЩҮ Ш§ЫҢЩҶ ЩҶШӘЫҢШ¬ЩҮ ШҜШіШӘ ЫҢШ§ЩҒШӘ Ъ©ЩҮ ШЁЩҮ Ш§ШІШ§ЫҢ ЩҮШұ ШҜЩҲ Щ…ЩҲЩ„Ъ©ЩҲЩ„ ATPШ§ЫҢ Ъ©ЩҮ ШҜШұ ЩҮШұ ЪҶШұШ®ЩҮ Ш§ШІ ЩҒШ№Ш§Щ„ЫҢШӘ ШўЩҶШІЫҢЩ… ЩҮЫҢШҜШұЩҲЩ„ЫҢШІ Щ…ЫҢвҖҢШҙЩҲЩҶШҜШҢ ШӘШ№ШҜШ§ШҜ ЩҫЫҢЪҶвҖҢШ®ЩҲШұШҜЪҜЫҢ Щ…Ш«ШЁШӘ ШҜШұ Ш·ЩҲЩ„ ШұШҙШӘЩҮЩ” ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШҜЩҲ ЩҲШ§ШӯШҜ Ъ©Ш§ЩҮШҙ ЩҫЫҢШҜШ§ Щ…ЫҢвҖҢЪ©ЩҶШҜ.[Ы·]
Ш§Ш«Шұ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ ШЁШұ ЪҳЫҢШұШ§ШІ
ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ ШҜШұ ШіЩ„ЩҲЩ„вҖҢЩҮШ§ЫҢ ЩҫШұЩҲЪ©Ш§ШұЫҢЩҲШӘЩҮШ§ ЩҲ ШЁШұШ®ЫҢ Ш§ШІ ЫҢЩҲЪ©Ш§ШұЫҢЩҲШӘЩҮШ§ ЩҲШ¬ЩҲШҜ ШҜШ§ШұШҜШҢ Ш§Щ…Ш§ ШЁШҜЫҢЩҶ ШҙЪ©Щ„ ЩҶЫҢШіШӘ Ъ©ЩҮ ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ ШҜШұ ШӘЩ…Ш§Щ… ШіЩ„ЩҲЩ„вҖҢЩҮШ§ЫҢ Ш§ЫҢЩҶ Щ…ЩҲШ¬ЩҲШҜШ§ШӘ Ъ©Ш§Щ…Щ„Ш§ЩӢ ЫҢЪ©ШіШ§ЩҶ ШЁШ§ШҙЩҶШҜ. Ш§ЫҢЩҶ ШўЩҶШІЫҢЩ… ШҜШұ ШіЩ„ЩҲЩ„вҖҢЩҮШ§ЫҢ Щ…Ш®ШӘЩ„ЩҒ ШҜШ§ШұШ§ЫҢ ШіШ§Ш®ШӘШ§Шұ ЩҲ ШӘЩҲШ§Щ„ЫҢ ЩҫШұЩҲШӘШҰЫҢЩҶЫҢ Щ…ШӘЩҒШ§ЩҲШӘЫҢ Ш§ШіШӘ Ъ©ЩҮ Ш§ЫҢЩҶ Ш®Ш§ШөЫҢШӘ ШіШЁШЁ Щ…ЫҢвҖҢШҙЩҲШҜ ШӘШ§ ЩҮШҜЩҒ Щ…ЩҶШ§ШіШЁЫҢ ШЁШұШ§ЫҢ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©ЩҮШ§ ШЁШ§ШҙШҜ. ШЁШұШ®ЫҢ Ш§ШІ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ Щ…ЫҢвҖҢШӘЩҲШ§ЩҶЩҶШҜ ШЁЩҮ ШөЩҲШұШӘ Ш®Ш§Шө ШЁШ®ШҙвҖҢЩҮШ§ЫҢ Ш®Ш§ШөЫҢ Ш§ШІ ШіШ§Ш®ШӘЩ…Ш§ЩҶ ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ ЫҢШ№ЩҶЫҢ ЩӮШіЩ…ШӘвҖҢЩҮШ§ЫҢ gyrA ЩҲ gyrB ШұШ§ Щ…Ш®ШӘЩ„ Ъ©ЩҶЩҶШҜ Щ…Ш§ЩҶЩҶШҜ Ш§ШіЫҢШҜ ЩҶШ§Щ„ЫҢШҜЫҢЪ©ШіЫҢЪ©.[Ыё] Ш§Щ…Ш§ ШҜЩҲ ШҜШіШӘЩҮ Ш§ШІ Щ…ЩҮЩ…ШӘШұЫҢЩҶ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ЫҢЫҢ Ъ©ЩҮ Ш§Ш«Шұ ШЁШ§ШІШҜШ§ШұЩҶШҜЪҜЫҢ ШЁШұ ШұЩҲЫҢ ШўЩҶШІЫҢЩ… ЪҳЫҢШұШ§ШІ ШҜШ§ШұЩҶШҜ ШЁЩҮ ШҙШұШӯ ШІЫҢШұ Ш§ШіШӘ:
- ШўЩ…ЫҢЩҶЩҲЪ©ШұШ§Щ…ЫҢЩҶЩҮШ§. Ш§ЫҢЩҶ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ ШЁШ§ Щ…ШӘШөЩ„ ШҙШҜЩҶ ШЁЩҮ ЩҶШ§ШӯЫҢЩҮвҖҢШ§ЫҢ Ш§ШІ ШўЩҶШІЫҢЩ… Ъ©ЩҮ ATPЩҮШ§ ШЁШұ ШўЩҶ ЩӮШұШ§Шұ Щ…ЫҢвҖҢЪҜШұЩҒШӘЩҶШҜ (ШҜЩҲ ШІЫҢШұЩӮШіЩ…ШӘ GryB)ШҢ ЪҶШұШ®ЩҮвҖҢШ§ЫҢ Ъ©ЩҮ ШўЩҶШІЫҢЩ… ШЁШұ Ш§ШіШ§Ші ШўЩҶ Ъ©Ш§Шұ Щ…ЫҢвҖҢЪ©ШұШҜ ШұШ§ Щ…Ш®ШӘЩ„ Щ…ЫҢвҖҢЪ©ЩҶЩҶШҜ ЩҲ ШҜШұ ЩҶШӘЫҢШ¬ЩҮ ШўЩҶШІЫҢЩ… ШҜЫҢЪҜШұ ЩӮШ§ШҜШұ ШЁЩҮ ЩҒШ№Ш§Щ„ЫҢШӘ ЩҶШ®ЩҲШ§ЩҮШҜ ШЁЩҲШҜ.
- ЩҒЩ„ЩҲШұЩҲЪ©ЫҢЩҶЩҲЩ„ЩҲЩҶЩҮШ§. Ш§ШІ Ш§ЫҢЩҶ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ ШЁЩҮ Ш№ЩҶЩҲШ§ЩҶ ЩӮШ§ШӘЩ„ ШӘЩҲЩҫЩҲШ§ЫҢШІЩҲЩ…ШұШ§ШІЩҮШ§ ЫҢШ§ШҜ Щ…ЫҢвҖҢШҙЩҲШҜ. Ш§ЫҢЩҶ ШҜШіШӘЩҮ Ш§ШІ ШўЩҶШӘЫҢвҖҢШЁЫҢЩҲШӘЫҢЪ©вҖҢЩҮШ§ ШЁШ§ Щ…ШӘШөЩ„ ШҙШҜЩҶ ШЁЩҮ ШіШ§Ш®ШӘЩ…Ш§ЩҶ ШўЩҶШІЫҢЩ…ШҢ ЩҒШ¶Ш§ЫҢ ШЁЫҢЩҶ DNA-gates ШұШ§ Ш§ШҙШәШ§Щ„ Щ…ЫҢвҖҢЪ©ЩҶЩҶШҜ ЩҲ Ш§ШІ ЩҫЫҢЩҲЩҶШҜ Ш®ЩҲШұШҜЩҶ ШҜЩҲ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ Ъ©ЩҮ Ш§ШІ ЩҮЩ…ШҜЫҢЪҜШұ ЪҜШіШіШӘЩҮ ШҙШҜЩҮ ШЁЩҲШҜЩҶШҜШҢ Ш¬Щ„ЩҲЪҜЫҢШұЫҢ Щ…ЫҢвҖҢЪ©ЩҶШҜ ЩҲ ШҜШұ ЩҶШӘЫҢШ¬ЩҮ ШҜШұ ЪҶШұШ®ЩҮЩ” ЩҒШ№Ш§Щ„ЫҢШӘ ШўЩҶШІЫҢЩ… Ш§Ш®ШӘЩ„Ш§Щ„ Ш§ЫҢШ¬Ш§ШҜ Щ…ЫҢвҖҢЪ©ЩҶШҜ. Ш§ЫҢЩҶ ЩҒШұШ§ЫҢЩҶШҜ ШЁШ§Ш№Ш« Щ…ЫҢвҖҢШҙЩҲШҜ Ъ©ЩҮ ШұШҙШӘЩҮ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢвҖҢЩҮШ§ЫҢ ЩҫШ§ШұЩҮ ШҙШҜЩҮ ШҜШұ ШҜШұЩҲЩҶ ШіЩ„ЩҲЩ„ Ш§ЩҶШЁШ§ШҙШӘЩҮ ШҙЩҲЩҶШҜ ЩҲ ЩҮЩ…Ш§ЩҶЩҶШҜШіШ§ШІЫҢ ШҜЫҢвҖҢШ§ЩҶвҖҢШ§ЫҢ ШЁЩҮ ШҜШұШіШӘЫҢ ШҙЪ©Щ„ ЩҶЪҜЫҢШұШҜ ЩҲ ШЁЩҮ Щ…ШұЪҜ ШіЩ„ЩҲЩ„ Щ…ЩҶШ¬Шұ Щ…ЫҢвҖҢШҙЩҲШҜ.
Ш¬ШіШӘШ§ШұЩҮШ§ЫҢ ЩҲШ§ШЁШіШӘЩҮ
ЩҫШ§ЩҶЩҲЫҢШі
- вҶ‘ ЫұЩ«Ы° ЫұЩ«Ыұ Garrett RH, Grisham CM (2013). Biochemistry (5th, International ed.). United States: Mary Finch. p. 949.
- вҶ‘ Wigley, D. B.; Davies, G. J.; Dodson, E. J.; Maxwell, A.; Dodson, G. (1991-06-20). "Crystal structure of an N-terminal fragment of the DNA gyrase B protein". Nature. 351 (6328): 624вҖ“629. doi:10.1038/351624a0. ISSN 0028-0836. PMID 1646964.
- вҶ‘ Morais Cabral, J. H.; Jackson, A. P.; Smith, C. V.; Shikotra, N.; Maxwell, A.; Liddington, R. C. (1997-08-28). "Crystal structure of the breakage-reunion domain of DNA gyrase". Nature. 388 (6645): 903вҖ“906. doi:10.1038/42294. ISSN 0028-0836. PMID 9278055.
- вҶ‘ Evans-Roberts, Katherine M.; Mitchenall, Lesley A.; Wall, Melisa K.; Leroux, Julie; Mylne, Joshua S.; Maxwell, Anthony (2016-02-12). "DNA Gyrase Is the Target for the Quinolone Drug Ciprofloxacin in Arabidopsis thaliana". The Journal of Biological Chemistry. 291 (7): 3136вҖ“3144. doi:10.1074/jbc.M115.689554. ISSN 1083-351X. PMC 4751362. PMID 26663076.
- вҶ‘ Bush, Natassja G.; Evans-Roberts, Katherine; Maxwell, Anthony (2015). "DNA Topoisomerases". EcoSal Plus. 6 (2). doi:10.1128/ecosalplus.ESP-0010-2014. ISSN 2324-6200. PMID 26435256.
- вҶ‘ Basu, Aakash; Parente, Angelica C.; Bryant, Zev (05 08, 2016). "Structural Dynamics and Mechanochemical Coupling in DNA Gyrase". Journal of Molecular Biology. 428 (9 Pt B): 1833вҖ“1845. doi:10.1016/j.jmb.2016.03.016. ISSN 1089-8638. PMC 5083069. PMID 27016205.
- вҶ‘ Reece, R. J.; Maxwell, A. (1991). "DNA gyrase: structure and function". Critical Reviews in Biochemistry and Molecular Biology. 26 (3вҖ“4): 335вҖ“375. doi:10.3109/10409239109114072. ISSN 1040-9238. PMID 1657531.
- вҶ‘ Engle, E. C.; Manes, S. H.; Drlica, K. (1982-1). "Differential effects of antibiotics inhibiting gyrase". Journal of Bacteriology. 149 (1): 92вҖ“98. ISSN 0021-9193. PMC 216595. PMID 6274849. ЩҶЪҜЩҮШҜШ§ШұЫҢ ЫҢШ§ШҜЪ©ШұШҜ:ЩҒШұЩ…ШӘ ЩҫШ§ШұШ§Щ…ШӘШұ PMC (link)
ЩҫЫҢЩҲЩҶШҜ ШЁЩҮ ШЁЫҢШұЩҲЩҶ
|
|---|
| ЩҒШ№Ш§Щ„ЫҢШӘ | |
|---|
| ЩӮЩҲШ§Ш№ШҜ | |
|---|
| ШҜШіШӘЩҮвҖҢШЁЩҶШҜЫҢ | |
|---|
| ШіЫҢЩҶШӘЫҢЪ© | |
|---|
| Ш§ЩҶЩҲШ§Ш№ | |
|---|