|
Kloramino
| Kloramino
|
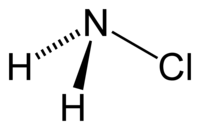
|
| Plata kemia strukturo de la Kloramino
|

|
| Tridimensia kemia strukturo de la Kloramino
|
| Kemia formulo |
NH2Cl
|

|
| Nitrogena triklorido, ankaŭ konata kiel trikloramino, estas flava oleeca substanco kun eksplodemaj proprecoj, kiu donis originon al esplorado pri la kloramino en 1811.
|
| CAS-numero-kodo |
10599-90-3
|
| ChemSpider kodo |
23735
|
| PubChem-kodo |
25423
|
| Fizikaj proprecoj
|
| Aspekto |
senkolora, koroda, toksa gaso kun baktericidaj proprecoj
|
| Molmaso |
51,473 g·mol−1
|
| Fandpunkto |
−66 °C
|
| Acideco (pKa) |
14
|
| Solvebleco |
Akvo:Tute solvebla
|
| Riskoj |
R19 R27/28 R45
|
| Riskoj |
S7 S22 S26 S36 S37 S39 S45
|
| Pridanĝeraj indikoj
|
| Danĝero
|
| GHS Damaĝo Piktogramo |
|
| GHS Signalvorto |
Damaĝa substanco
|
| GHS Deklaroj pri damaĝoj |
H290, H314, H315, H319, H335, H372, H412
|
| GHS Deklaroj pri antaŭgardoj |
P234, P260, P261, P264, P270, P271, P273, P280, P301+330+331, P302+352, P303+361+353, P304+340, P305+351+338, P310, P314, P321, P332+313, P337+313, P362, P363, P403+233, P404, P405, P501[1]
|
Escepte kiam indikitaj, datumoj estas prezentataj laŭ iliaj normaj kondiĉoj pri temperaturo kaj premo
(25 °C kaj 100 kPa)
|
Kloramino aŭ NH2Cl estas neorganika amoniaka kombinaĵo de kloro, senkolora, koroda, toksa gaso kun baktericidaj proprecoj uzata en akvotraktado kiel biocido kaj en kemiaj sintezoj. Kloraminoj estas uzataj kiel malinfektiloj pro tio ke ili estas malpli agresivaj ol klorogaso kaj pli stabilaj rilate al sunlumo kaj hipokloritoj. Malgraŭ la sendiskriminacia uzo, la produkto estas karcinomogena, toksa kaj baktericido.
Kloraminoj estis unue raportitaj en 1811, de la franca fizikisto Pierre Louis Dulong (1785-1838) (kaj post du jaroj (1813), Louis-Jacques Thenard (1777-1857) kaj Claude Louis Berthollet (1748-1822)) post provo de preparado de eksplodaĵo konata kiel trikloramino. Tamen, nur en 1907, la germana kemiisto Friedrich Raschig (1863-1928) unue preparis la substancon. Raschig, laborante kun anilino kaj hipokloritoj konstatis ke nenia koloro estiĝis kiam ĉi-du produktoj miksiĝas en ĉeesto de amoniako.[2]
Sintezoj
Sintezo 1
Sintezo 2
Sintezo 3
Sintezo 4
- Preparado per trakado de fluoramino kaj kalcia klorido:
Sintezo 5
Sintezo 6
Reakcioj
Reakcio 1
- Malkomponado de kloramino:
Reakcio 2
Reakcio 3
Reakcio 4
Reakcio 5
- Reakcio de kloramino, nitrogena triklorido en akva medio:
Reakcio 6
Reakcio 7
- Kloramino transformas nitritojn en nitratojn:[3]
Reakcio 8
- Nitrogenigo de benzeno per kloramino:
Reakcio 9
- Kloramino transformas tiosulfatojn en bisulfatojn:[4]
Reakcio 10
- Kloramino transformas tiosulfatojn en sulfatojn kun unu molumo da akvo:
Vidu ankaŭ
Literaturo
Referencoj
|
|