Octan rhodnatý je organická sloučenina, rhodnatá sůl kyseliny octové. Je to tmavě zelený prášek, který se rozpouští v polárních rozpouštědlech (například ve vodě). Používá se jako katalyzátor cyklopropanace alkenů.
Příprava
Octan rhodnatý se často připravuje zahříváním hydrátu chloridu rhoditého v kyselině octové:[2]
Chemické vlastnosti
U dimeru octanu rhodnatého může proběhnout ligandová výměna, kdy je octanová skupina nahrazena jiným karboxylátem nebo podobnou skupinou.[3]
- Rh2(OAc)4 + 4 HO2CR → Rh2(O2CR)4 + 4 HOAc
Z řady reakcí, kde je tato látka katalyzátorem, lze zmínit například zavedení vazeb O–H a N–H do molekul a cyklopropanaci alkenů[4] a aromatických sloučenin.[5] Octan rhodnatý se rovněž selektivně váže na ribonukleosidy (nikoliv ovšem na deoxynukleosidy), konkrétně na jejich 2′- a 3′-hydroxylové skupiny.[6]
Dimer octanu rhodnatého je oproti octanu měďnatému reaktivnější a vhodnější k odlišení ribonukleosidů od deoxynukleosidů díky své rozpustnosti ve vodných roztocích, zatímco octan měďnatý se v nich nerozpouští.
Vybrané katalyzované reakce
Octan rhodnatý lze použít k zavedení vazeb X-H (kde X je C, N, S nebo O).
- Cyklopropanace probíhá skrz rozklad diazokarbonylových sloučenin, může dojít k vnitromolekulární i mezimolekulární cyklopropanaci.

- Aromatická cykloadice: Octan rhodnatý katalyzuje jak dvousložkové, tak i třísložkové 1,3-dipolární cykloadice.
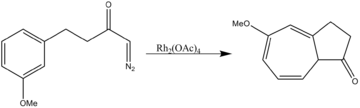
- Oxidace alkoholů: Allylové a benzylové alkoholy se oxidují na odpovídající karbonylové sloučeniny terc-butylhydroperoxidem ve stechiometrickém množství, za přítomnosti dimeru octanu rhodnatého Rh2(OAc)4 jako katalyzátoru, v dichlormethanu za pokojové teploty.

Reference
V tomto článku byl použit překlad textu z článku Rhodium(II) acetate na anglické Wikipedii.
- ↑ a b Rhodium(II) acetate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ REMPEL, G. A.; LEGZDINS, P.; SMITH, H.; WILKINSON, G. Tetrakis(acetato)dirhodium(II) and Similar Carboxylato Compounds. Inorg. Synth.. 1972, s. 90. ISBN 9780470132449. DOI 10.1002/9780470132449.ch16. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
- ↑ DOYLE, M. P. Catalytic Asymmetric Synthesis. Redakce Ojima Iwao. 2nd. vyd. New York: Wiley, 2000. ISBN 0-471-29805-0. Kapitola Asymmetric Addition and Insertion Reactions of Catalytically-Generated Metal Carbenes. Je zde použita šablona
{{Cite book}} označená jako k „pouze dočasnému použití“.
- ↑ HUBERT, A. J.; FERON, A.; WARIN, R.; TEYSSIE, P. Synthesis of iminoaziridines from carbodiimides and diazoesters : A new example of transition metal salt catalysed reactions of carbenes. Tetrahedron Lett.. 1976, s. 1317. DOI 10.1016/S0040-4039(00)78050-6. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
- ↑ ANCIAUX, A. J.; DEMONCEAU, A.; HUBERT, A. J.; NOELS, A. F.; PETINIOT, N.; TEYSSIÉ, P. Catalytic control of reactions of dipoles and carbenes; an easy and efficient synthesis of cycloheptatrienes from aromatic compounds by an extension of Buchner's reaction. J. Chem. Soc., Chem. Commun.. 1980, s. 765. DOI 10.1039/C39800000765. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
- ↑ BERGER, N. A.; TARIEN, E.; EICHHORN, G. L. Stereoselective Differentiation between Ribonucleosides and Deoxynucleosides by Reaction with the Copper(II) Acetate Dimer. Nature New Biology. 1972, s. 237. Dostupné online. DOI 10.1038/newbio239237a0. PMID 4538853. Je zde použita šablona
{{Cite journal}} označená jako k „pouze dočasnému použití“.
Externí odkazy