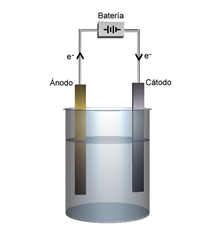
Cel·la electroquímica
|
Read other articles:

Османская Венгрия (венг. Török hódoltság) — общее название территорий Османской империи, населённых преимущественно этническими венграми. После поражения объединённого венгро-чешско-хорватского войска в битве при Мохаче 29 августа 1526 года большая часть венгерских земель п

هذه مقالة غير مراجعة. ينبغي أن يزال هذا القالب بعد أن يراجعها محرر مغاير للذي أنشأها؛ إذا لزم الأمر فيجب أن توسم المقالة بقوالب الصيانة المناسبة. يمكن أيضاً تقديم طلب لمراجعة المقالة في الصفحة المخصصة لذلك. (يونيو 2020) هذه المقالة يتيمة إذ تصل إليها مقالات أخرى قليلة جدًا. فض�...

Tupá Tupá als herausstechender Berg am Kamm im linken Teil des Bilds, von der Ostrva heraus gesehen Höhe 2284 m n.m. Lage Slowakei Gebirge Hohe Tatra Koordinaten 49° 9′ 13″ N, 20° 6′ 6″ O49.15352820.1017782284Koordinaten: 49° 9′ 13″ N, 20° 6′ 6″ O Tupá (Berg) (Slowakei) Typ Felsgipfel Blick auf Tupá (links) vom oberen Teil des Tals Mengusovská dolina heraus Die Tupá (deutsch und ungarisch Tupa, po...

Bogislao XIII de Pomerania Duque de Pomerania Información personalNacimiento 9 de agosto de 1544Fallecimiento 7 de marzo de 1606StettinFamiliaCasa real Casa de PomeraniaPadre Felipe IMadre María de SajoniaConsorte Clara de Brunswick-Luneburgo Ana de Schleswig-Holstein-Sonderburg[editar datos en Wikidata] Bogislao XIII de Pomerania (en polaco Bogusław XIII; 9 de agosto de 1544-7 de marzo de 1606, Stettin; en polaco: Szczecin), hijo de Felipe I y María de Sajonia, fue un príncipe...

ن-مثيل-د-حمض الأسبارتيك حمض الغلوتاميك مستقبل ن-مثيل-د-أسبارتات (بالإنجليزية: N-methyl-D-aspartate receptor)، اختصاره «مستقبل إن إم دي إيه» أو «إن إم دي إيه آر»، مستقبل غلوتامات وقناة شاردية توجد في الخلايا العصبية. يمثل هذا المستقبل أحد الأنواع الثلاثة من مستقبلات الغلوتامات المؤثرة في...

Jin Matsubara (松原 仁code: ja is deprecated , Matsubara Jin, lahir 31 Juli 1956) adalah seorang politikus Jepang. Ia adalah anggota Dewan Perwakilan Rakyat dalam Parlemen (legislatur nasional). Ia diangkat menjadi Ketua Komisi Keamanan Masyarakat Nasional, Menteri Urusan Konsumen dan Keamanan Pangan dan Menteri Masalah Penculikan. Matsubara dulunya berafiliasi dengan Partai Harapan dan Partai Demokrat. Referensi Pranala luar Situs web resmi in Japanese. Pengawasan otoritas Umum VIAF 1 Wor...

Progresnya Berapa Persen?Genre Drama Komedi Misteri PembuatViu OriginalBerdasarkanProgresnya Berapa Persen?oleh Soraya NasutionDitulis olehFatmaningsihSutradaraAdhe DharmastriyaPemeran Michelle Ziudith Omar Daniel Victor Agustino Alika Jantinia Aulia Deas Alfian Phang Kia Poetri Bernie Allen Lagu pembukaPanah Asmara – AfganLagu penutupPanah Asmara – AfganMusikNicanoorNegara asalIndonesiaBahasa asliBahasa IndonesiaJmlh. musim1Jmlh. episode15ProduksiProduser eksekutif Ajivit Dutta Toha Essa...

Untuk kelas kapal penjelajah Austro-Hungaria dengan nama yang sama, lihat Kapal penjelajah kelas Zara (1879). Kapal penjelajah berat kelas Zara Kapal penjelajah Italia Zara Tentang kelas Nama:Kelas ZaraOperator: Regia MarinaDidahului oleh:Kapal penjelajah kelas-TrentoDigantikan oleh:BolzanoDibangun:1929-1932Bertugas:1931-1944Selesai:4Hilang:4 Ciri-ciri umum Kelas dan jenis Kapal penjelajah beratBerat benaman 11.326 hingga 11.712 ton panjang (11.508 hingga 11.900 t) (standar) 13...

Ini adalah nama Tionghoa; marganya adalah Yuan. Yuan ShanshanYuan Shan Shan pada tahun 2018Lahir22 Februari 1987 (umur 36)Distrik Xiangcheng, Xiangyang, Hubei, TiongkokNama lainMabel YuanAlmamaterAkademi Film BeijingPekerjaan Pemeran Penyanyi Tahun aktif2008–sekarangAgenHuanyu Film Yuan Shanshan Hanzi: 袁姍姍 Alih aksara Mandarin - Hanyu Pinyin: Yuán Shānshān Yuan Shanshan (Hanzi: 袁姗姗, lahir 22 Februari 1987) juga dikenal sebagai Mabel Yuan adalah seorang peme...

Henri Frédéric Amiel (27 September 1821 – 11 Mei 1881) adalah seorang filsuf, penyair dan kritikus dari Swiss. Dilahirkan di Jenewa pada 1821, ia adalah keturunan keluarga Huguenot yang mengungsi ke Swiss karena Edict of Nantes. Kehilangan orangtuanya pada usia muda, Amiel berkelana dan bertemu dengan pemimpin-pemimpin intelektual di Eropa, mempelajari filosofi Jerman di Berlin. Pada 1849 ia ditunjuk sebagai profesor estetik di Academy of Jenewa, dan pada 1854 menjadi profes...

Vichai SrivaddhanaprabhaSrivaddhanaprabha di Ham Polo Club pada tahun 2010LahirVichai Raksriaksorn(1958-06-05)5 Juni 1958[1]Bangkok, ThailandMeninggal27 Oktober 2018(2018-10-27) (umur 60)[2]Stadion King Power, Leicester, InggrisSebab meninggalKecelakaan helikopterKebangsaanThaiPekerjaanPemilik & ketua King Power International GroupPemilik & ketua Leicester CityKetua OH LeuvenKekayaan bersihUS$ 4,9 miliar (Oktober 2018)[1]Suami/istriAimon Srivaddh...

West Islip (New York)GéographiePays États-UnisÉtat New YorkComté comté de SuffolkSuperficie 17,52 km2 (2010)Surface en eau 6,46 %Altitude 6 mCoordonnées 40° 42′ 54″ N, 73° 17′ 52″ ODémographiePopulation 27 048 hab. (2020)Densité 1 543,8 hab./km2 (2020)FonctionnementStatut Localité de recensement aux États-Unis, communauté non incorporée aux États-Unis (d)IdentifiantsCode postal 11795Code FIPS 36-80302GNIS 96...

2001 film by Srilal Priyadeva Jolly Hallo ජොලි හලෝDirected bySrilal PriyadevaWritten bySrilal PriyadevaBased onSrilal PriyadevaProduced byNimalaweera FilmsStarringBandu Samarasinghe Nilanthi Dias Freddie Silva Arjuna KamalanathCinematographyM. H. GafoorEdited bySrilal PriyadevaMusic byMervyn PriyanthaProductioncompaniesPrasad Color Lab Sarasavi LabRelease date6 September 2001Running time120 minutesCountrySri LankaLanguageSinhala Jolly Hallo (Sinhala: ජොලි හලෝ) is a...

Parliamentary constituency in the United Kingdom, 1918–1983 AbertilleryFormer County constituencyfor the House of Commons1918–1983SeatsoneCreated fromWest MonmouthshireReplaced byBlaenau Gwent and Islwyn Abertillery was a county constituency centred on the town of Abertillery in Monmouthshire. It returned one Member of Parliament (MP) to the House of Commons of the Parliament of the United Kingdom, elected by the first past the post system of election. From 1950 up to (and including) 1970...

This article needs additional citations for verification. Please help improve this article by adding citations to reliable sources. Unsourced material may be challenged and removed.Find sources: List of Philippines Football League stadiums – news · newspapers · books · scholar · JSTOR (August 2022) (Learn how and when to remove this template message) Since the first season of the Philippines Football League, league matches have been played in 11 stadiu...

2013 single by NONONOPumpin BloodSingle by NONONOfrom the album We Are Only What We Feel Released8 April 2013 (2013-04-08)GenreIndie popLength3:29LabelWarner MusicSongwriter(s) Tobias Jimson Michel Flygare Stina Wäppling Producer(s)Astma & RocwellNONONO singles chronology Pumpin Blood (2013) Like the Wind (2013) Pumpin Blood is a song by Swedish trio NONONO. It was released on 8 April 2013 through Warner Music as the lead single from the band's debut studio album, We Are O...

Obsolete linguistic and archaeological theory Neolithic stone-axe from Sweden The North European hypothesis was a linguistic and archaeological theory that tried to explain the spread of the Indo-European languages in Europe and parts of Asia by locating the original homeland (Urheimat) in southern Scandinavia or in the North German Plain.[1] This hypothesis, advanced by Karl Penka, Hermann Hirt, Gustaf Kossinna and others, had some success in the late 19th century and the early 20th ...

Neighbourhood of Karachi Suburb in Central Karachi, Sindh, PakistanNorth Nazimabad نارتھ ناظم آبادSuburbNorth Nazimabad is an upper-middle class suburb of KarachiCountryPakistanProvinceSindhDistrictCentral KarachiEstablished1958Government • ACHazim Bangwar • ConstituencyNA-256 (Karachi Central-IV) • National Assembly MemberNajeeb Haroon (PTI) North Nazimabad (Urdu: نارتھ ناظم آباد) is a suburb of, Karachi, Pakistan. North Nazimabad...

Taman Nasional Gunung MerapiIUCN Kategori II (Taman Nasional)Gunung MerapiTN Gunung MerapiLokasi di Pulau JawaLetakDaerah Istimewa Yogyakarta dan Jawa Tengah, IndonesiaKota terdekatKota YogyakartaKota MagelangKoordinat7°32′49″S 110°26′40″E / 7.54694°S 110.44444°E / -7.54694; 110.44444Koordinat: 7°32′49″S 110°26′40″E / 7.54694°S 110.44444°E / -7.54694; 110.44444Luas6.410 hektare (64,1 km²)Didirikan2004Pihak pengelolaKemen...

Palace in Bagmati Province, NepalNuwakot Durbar ComplexNuwakot Palace in 2015Nuwakot Palace ComplexLocation within Bagmati ProvinceShow map of Bagmati ProvinceNuwakot Palace ComplexNuwakot Palace Complex (Nepal)Show map of NepalGeneral informationTypePalaceArchitectural styleNepalese architectureLocationNuwakot, Nuwakot District, Bagmati ProvinceCountryNepalCoordinates27°54′50″N 85°09′53″E / 27.913760831186664°N 85.16475430315691°E / 27.913760831186664; 85....