| ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є
|
|
|
|
ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ђа¶≤ටаІЗ ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶Єа¶Ња¶∞а¶£а¶ња¶∞ ಲಁටඁ පаІНа¶∞аІЗа¶£аІАа¶∞[аІІ] а¶ЃаІМа¶≤а¶ЧаІБа¶≤аІЛа¶ХаІЗ а¶ђаІЛа¶Эа¶Ња¶ѓа¶Ља•§ а¶Ха¶Цථа¶Уа¶ђа¶Њ а¶Па¶ХаІЗ а¶Еа¶ЈаІНа¶Яа¶Ѓ පаІНа¶∞аІЗа¶£аІА, а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඙а¶∞а¶ња¶ђа¶Ња¶∞ а¶ђа¶Њ ථගඃඊථ ඙а¶∞а¶ња¶ђа¶Ња¶∞ ථඌඁаІЗ а¶°а¶Ња¶Ха¶Њ а¶єа¶ѓа¶Ља•§ а¶За¶Ва¶∞аІЗа¶ЬගටаІЗ а¶Єа¶Ъа¶∞а¶Ња¶Ъа¶∞ Gas а¶єа¶ња¶Єа¶Ња¶ђаІЗ а¶Еа¶≠а¶ња¶єа¶ња¶§а•§ а¶Па¶З පаІНа¶∞аІЗа¶£аІАටаІЗ а¶Еа¶ђа¶ЄаІНඕගට а¶ЧаІНа¶ѓа¶Ња¶Єа¶ЧаІБа¶≤аІЛ а¶∞ඌඪඌඃඊථගа¶Ха¶≠а¶Ња¶ђаІЗ а¶ЦаІБа¶ђа¶З ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ, а¶Ха¶Ња¶∞а¶£ а¶ПබаІЗа¶∞ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶∞а¶ЄаІНඕ а¶Ха¶ХаІНඣ඙ඕаІЗ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථаІЗа¶∞ а¶Єа¶Ва¶ЦаІНа¶ѓа¶Њ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђаІЛа¶ЪаІНа¶Ъ а¶Іа¶Ња¶∞а¶£ а¶ХаІНඣඁටඌа¶∞ ඪඁඌථ а¶Еа¶∞аІНඕඌаІО аІЃа¶Яа¶ња•§ а¶Зටගඁ඲аІНа¶ѓаІЗ а¶ЄаІБа¶ЄаІНඕගට а¶За¶≤аІЗа¶ХаІНа¶ЯаІНа¶∞а¶£а¶Єа¶ЃаІВа¶є а¶ЕථаІНа¶ѓ а¶ХаІЛථ а¶ЃаІМа¶≤аІЗа¶∞ ඪඌඕаІЗ а¶Єа¶єа¶ЬаІЗ а¶ђа¶ња¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Њ а¶Ха¶∞ටаІЗ а¶Ъа¶Ња¶ѓа¶Љ а¶®а¶Ња•§ а¶Єа¶Ња¶Іа¶Ња¶∞а¶£ а¶Еа¶ђа¶ЄаІНඕඌඃඊ а¶Па¶ЧаІБа¶≤аІЛ а¶ђа¶∞аІНа¶£а¶єаІАථ, а¶ЧථаІНа¶Іа¶єаІАථ а¶Йа¶ЪаІНа¶Ъ а¶Жඃඊථගа¶Х а¶ђа¶ња¶≠а¶ђ а¶Єа¶ЃаІН඙ථаІНථ а¶Па¶ђа¶В а¶Па¶Х ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Х а¶ЧаІНа¶ѓа¶Ња¶Єа•§ а¶Й඙а¶∞ථаІНටаІБ а¶Па¶ЧаІБа¶≤аІЛа¶∞ а¶ЄаІНа¶ЂаІБа¶Яථඌа¶Ва¶Х а¶У а¶Ча¶≤ථඌа¶Ва¶Х а¶ЦаІБа¶ђа¶З а¶Ха¶Ња¶Ыа¶Ња¶Ха¶Ња¶Ыа¶ња•§ а¶Жа¶≤аІЛа¶Ха¶Єа¶ЬаІНа¶Ьа¶Њ, а¶Уа¶ѓа¶ЉаІЗа¶≤аІНа¶°а¶ња¶В а¶Па¶ђа¶В ඁයඌපаІВථаІНа¶ѓ ඙аІНа¶∞а¶ѓаІБа¶ХаІНටගටаІЗ а¶Па¶З а¶ЧаІНа¶ѓа¶Ња¶Єа¶ЧаІБа¶≤аІЛа¶∞ ඙аІНа¶∞а¶≠аІВට а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶∞а¶ѓа¶ЉаІЗа¶ЫаІЗа•§ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Єа¶Ва¶ЦаІНа¶ѓа¶Њ а¶Єа¶Ња¶§а•§ а¶Па¶ЧаІБа¶≤аІЛ а¶єа¶≤: а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ, ථගඃඊථ, а¶Жа¶∞аІНа¶Чථ, а¶ХаІНа¶∞ග඙аІНа¶Яථ, а¶ЬаІЗථථ, а¶∞вАМаІНඃඌධථ а¶Па¶ђа¶В а¶Уа¶ЧඌථаІЗа¶Єа¶®а•§[аІ®]а¶Па¶ХаІЗ ථаІЛа¶ђаІЗа¶≤ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ђа¶≤а¶Њ а¶єа¶ѓа¶Љ
а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗа¶∞ а¶Зටගයඌඪ
ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ а¶∞ඪඌඃඊථаІЗа¶∞ а¶ЗටගයඌඪаІЗ а¶Па¶Ха¶Яа¶њ ඐගපаІЗа¶Ј а¶Йа¶≤аІНа¶≤аІЗа¶Ца¶ѓаІЛа¶ЧаІНа¶ѓ а¶Ша¶Яа¶®а¶Ња•§ аІІаІ≠аІЃаІЂ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ а¶ђа¶ња¶ЬаІНа¶ЮඌථаІА а¶ХаІНа¶ѓа¶Ња¶≠аІЗථධගඪ а¶Па¶Ха¶Яа¶њ а¶ЖඐබаІНа¶І ඙ඌටаІНа¶∞аІЗ а¶Ха¶ЄаІНа¶Яа¶ња¶Х а¶ЄаІЛа¶°а¶Њ බаІНа¶∞а¶ђа¶£аІЗа¶∞ а¶Й඙а¶∞ а¶Еටගа¶∞а¶ња¶ХаІНට а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථඃаІБа¶ХаІНට а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ а¶ђа¶Ња¶∞ а¶ђа¶Ња¶∞ ඐගබаІНа¶ѓаІБаІО а¶ЄаІНа¶ЂаІБа¶≤а¶ња¶Ва¶Ч ඙аІНа¶∞а¶ѓа¶ЉаІЛа¶Ч а¶Ха¶∞аІЗ а¶Еටග ඪඌඁඌථаІНа¶ѓ ඙а¶∞а¶ња¶Ѓа¶Ња¶£ а¶ђа¶Ња¶ѓа¶ЉаІБа¶∞ а¶ЃаІВа¶≤ а¶ЖඃඊටථаІЗа¶∞ ඙аІНа¶∞а¶Ња¶ѓа¶Љ аІІаІ®аІ¶/аІІ а¶≠а¶Ња¶Ч а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶Ј ඙аІЗа¶≤аІЗа¶®а•§ ටගථග ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞а¶≤аІЗථ а¶ѓаІЗ, а¶Па¶З ඙аІНа¶∞а¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Ња¶ѓа¶Љ а¶Єа¶Ѓа¶ЄаІНට ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථа¶З а¶Еа¶ХаІНа¶Єа¶Ња¶За¶°аІЗ ඙а¶∞а¶ња¶£а¶§ а¶єа¶ѓа¶Љ а¶Па¶ђа¶В බаІНа¶∞а¶ђа¶£аІЗ а¶ЕඐපаІЛඣගට а¶єа¶ѓа¶ЉаІЗ ඪඌඁඌථаІНа¶ѓ ඙а¶∞а¶ња¶Ѓа¶Ња¶£ а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶Ј ඕඌа¶ХаІЗа•§ ටගථග а¶Жа¶∞а¶У ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞а¶≤аІЗථ а¶ѓаІЗ,а¶Па¶З а¶ЕඐගපඣаІНа¶Я а¶ЧаІНа¶ѓа¶Ња¶Є ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Е඙аІЗа¶ХаІНа¶Ја¶Ња¶У ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Ља•§ а¶ХаІНа¶ѓа¶Ња¶≠аІЗථධගඪаІЗа¶∞ а¶Па¶З ඙а¶∞аІАа¶ХаІНа¶Ја¶Ња¶∞ ටඌаІО඙а¶∞аІНа¶ѓ а¶ђа¶ња¶ЬаІНа¶ЮඌථаІАබаІЗа¶∞ ථගа¶Ха¶Я ඙а¶∞а¶ђа¶∞аІНටаІА ඙аІНа¶∞а¶Ња¶ѓа¶Љ а¶Па¶Хපට а¶ђа¶∞аІНа¶Ј а¶Й඙аІЗа¶ХаІНඣගට а¶Ыа¶ња¶≤а•§
аІІаІЃаІѓаІ™ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ, а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථ ඙аІНа¶∞а¶≠аІГටග а¶ђа¶ња¶≠ගථаІНථ а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ ඙බඌа¶∞аІНඕаІЗа¶∞ а¶ШථටаІНа¶ђ ඙а¶∞ගඁඌ඙ а¶Ха¶∞ටаІЗ а¶Ча¶ња¶ѓа¶ЉаІЗ а¶≤а¶∞аІНа¶° а¶∞аІЗа¶≤аІЗ (Lord Rayleigh) ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞аІЗථ а¶ѓаІЗ, а¶ђа¶ња¶≠ගථаІНථ а¶ЙаІОа¶Є ඕаІЗа¶ХаІЗ ඙аІНа¶∞ඌ඙аІНට а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථаІЗа¶∞ а¶ШථටаІНа¶ђ ඙аІНа¶∞ටග а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ а¶Еа¶≠ගථаІНථ а¶єа¶≤аІЗа¶У ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථаІЗа¶∞ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ а¶Ђа¶≤а¶Ња¶Ђа¶≤ а¶≠ගථаІНථа¶∞аІВа¶™а•§ ටගථග ටගථ ඙බаІН඲ටගටаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Жа¶єа¶∞а¶£ а¶Ха¶∞а¶≤аІЗа¶®а•§ ඃඕඌа¶Г (а¶Х) а¶ЕаІНа¶ѓа¶Ња¶ЃаІЛථගඃඊඌඁ ථඌа¶За¶ЯаІНа¶∞а¶Ња¶За¶Яа¶ХаІЗ а¶ЙටаІНටඌ඙ගට а¶Ха¶∞аІЗ, (а¶Ц)ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Еа¶ХаІНа¶Єа¶Ња¶За¶°а¶ХаІЗ а¶ЙටаІНට඙аІНට а¶≤аІМа¶є а¶ѓаІЛа¶ЧаІЗ а¶ђа¶ња¶Ьа¶Ња¶∞ගට а¶Х'а¶∞аІЗ а¶У (а¶Ч) а¶ЄаІЛа¶°а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶єа¶Ња¶З඙аІЛа¶ђаІНа¶∞аІЛа¶Ѓа¶Ња¶За¶ЯаІЗа¶∞ а¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Ња¶ѓа¶Љ а¶За¶Йа¶∞а¶ња¶ѓа¶Ља¶Њ ඕаІЗа¶ХаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Єа¶Ва¶ЧаІНа¶∞а¶є а¶Ха¶∞а¶Ња•§ а¶ђа¶ња¶ЄаІНа¶Ѓа¶ѓа¶ЉаІЗа¶∞ а¶Єа¶ЩаІНа¶ЧаІЗ ටගථග а¶≤а¶ХаІНа¶ЈаІНа¶ѓ а¶Ха¶∞а¶≤аІЗථ а¶ѓаІЗ а¶ђа¶Ња¶ѓа¶ЉаІБ යටаІЗ ඙аІНа¶∞ඌ඙аІНට ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶∞ඌඪඌඃඊථගа¶Х а¶Й඙ඌඃඊаІЗ ඙аІНа¶∞ඌ඙аІНට ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ а¶≠а¶Ња¶∞аІАа•§ а¶ПටаІЗ ඙аІНа¶∞ටаІАඃඊඁඌථ а¶єа¶≤аІЛ а¶ѓаІЗ, а¶ђа¶Ња¶ѓа¶Ља¶ђаІАа¶ѓа¶Љ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶ђаІНඃටаІАට а¶≠ගථаІНථ а¶ХаІЛථ а¶Й඙ඌබඌථ а¶∞а¶ѓа¶ЉаІЗа¶ЫаІЗа•§ а¶Еටа¶Г඙а¶∞ а¶∞аІЗа¶≤аІЗ а¶ХаІНа¶ѓа¶Ња¶≠аІЗථධගඪаІЗа¶∞ а¶ЕථаІБа¶∞аІВ඙ ඙а¶∞аІАа¶ХаІНа¶Ја¶Ња¶Ха¶Ња¶∞аІНа¶ѓ а¶Ъа¶Ња¶≤а¶ња¶ѓа¶ЉаІЗ ඙аІНа¶∞ඌ඙аІНට а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶ЈаІЗ (residual gas) а¶ђа¶∞аІНа¶£а¶Ња¶≤аІА ඐගපаІНа¶≤аІЗа¶Ја¶£ а¶Х'а¶∞аІЗ а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ ඐගබаІНඃඁඌථ, ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ а¶≠а¶Ња¶∞аІА а¶Еඕа¶Ъ ටබඌඐ඲ග а¶ЕථඌඐගඣаІНа¶ХаІГට а¶ХаІЛථ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Еа¶ЄаІНටගටаІНа¶ђ а¶Ха¶≤аІН඙ථඌ а¶Ха¶∞аІЗа¶®а•§ ඙а¶∞аІЗ а¶ђа¶ња¶ЬаІНа¶ЮඌථаІА а¶∞аІЗа¶≤аІЗ'а¶Па¶∞ а¶ЕථаІБඁටගа¶ХаІНа¶∞а¶ЃаІЗ а¶Йа¶За¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ (Ramsay) а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶Ја¶Яа¶њ ඙аІГඕа¶Х а¶Ха¶∞ටаІЗ а¶ЪаІЗа¶ЈаІНа¶Яа¶Њ а¶Ха¶∞аІЗа¶®а•§ а¶Ха¶Ња¶∞аІНඐථ а¶°а¶Ња¶З-а¶Еа¶ХаІНа¶Єа¶Ња¶За¶° а¶У а¶Ьа¶≤аІАа¶ѓа¶Љ а¶ђа¶Ња¶ЈаІН඙ඐගයаІАථ а¶ђа¶Ња¶ѓа¶ЉаІБ ථගඃඊаІЗ а¶ЄаІЗа¶З а¶ђа¶Ња¶ѓа¶ЉаІБ а¶ђа¶Ња¶∞ а¶ђа¶Ња¶∞ ට඙аІНට а¶ЃаІНа¶ѓа¶Ња¶ЧථаІЗа¶Єа¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶У඙а¶∞ බගඃඊаІЗ ඙аІНа¶∞ඐඌයගට а¶Ха¶∞аІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථа¶ХаІЗ а¶ЃаІНа¶ѓа¶Ња¶ЧථаІЗа¶Єа¶ња¶ѓа¶Ља¶Ња¶Ѓ ථඌа¶За¶ЯаІНа¶∞а¶Ња¶За¶° а¶єа¶ња¶ЄаІЗа¶ђаІЗ බаІНа¶∞а¶ђаІАа¶≠аІВට а¶Ха¶∞а¶Њ а¶єа¶ѓа¶Ља¶Г 3Mg +N2 = Mg3N2; а¶Па¶ђа¶В ඙а¶∞а¶ња¶≤а¶ХаІНඣගට а¶єа¶ѓа¶Љ а¶ѓаІЗ, а¶ЃаІВа¶≤ а¶ЖඃඊටථаІЗа¶∞ аІЃаІ¶/аІІ а¶≠а¶Ња¶Ч а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶ЈаІЗ ඕаІЗа¶ХаІЗ а¶ѓа¶Ња¶ѓа¶Ља•§ а¶Еඕа¶Ъ NO, N2O, NH4NO2 ඙аІНа¶∞а¶≠аІГටග ඕаІЗа¶ХаІЗ а¶ЙаІОа¶Єа¶Ња¶∞ගට ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථа¶ХаІЗ а¶ХаІНа¶∞ඁඌථаІНа¶ђа¶ѓа¶ЉаІЗ а¶ЙටаІНට඙аІНට ටඌඁඌ а¶У а¶ЃаІНа¶ѓа¶Ња¶ЧථаІЗа¶Єа¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶У඙а¶∞ බගඃඊаІЗ а¶Ъа¶Ња¶≤ථඌ а¶Ха¶∞аІЗ ඙а¶∞а¶ња¶≤а¶ХаІНඣගට а¶єа¶ѓа¶Љ а¶ѓаІЗ, а¶ХаІЛථ а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶Ј а¶ЖබаІМ ඕඌа¶ХаІЗ а¶®а¶Ња•§ а¶∞аІЗа¶≤аІЗ а¶У а¶Йа¶За¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶ња¶∞ ඙аІНа¶∞ඌ඙аІНට а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶ЈаІЗа¶∞ а¶ђа¶∞аІНа¶£а¶Ња¶≤а¶њ ඐගපаІНа¶≤аІЗа¶Ја¶£аІЗ а¶Єа¶ЃаІН඙аІВа¶∞аІНа¶£ а¶Еа¶ЬаІНа¶Юඌට а¶Єа¶ђаІБа¶Ь а¶У а¶≤а¶Ња¶≤ а¶∞аІЗа¶Ца¶Њ а¶ђа¶∞аІНа¶£а¶Ња¶≤аІАа¶∞ ඪථаІН඲ඌථ а¶≤а¶Ња¶≠ а¶Ха¶∞аІЗа¶®а•§ ඙а¶∞а¶ња¶≤а¶ХаІНඣගට а¶єа¶≤аІЛ а¶ѓаІЗ, а¶Па¶∞ а¶ШථටаІНа¶ђ аІІаІѓ.аІѓаІ™ (H-1), ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ аІ™аІ¶ а¶Па¶ђа¶В а¶Па¶Яа¶њ а¶∞ඌඪඌඃඊථගа¶Х а¶ђа¶ња¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Ња¶ѓа¶Љ а¶Па¶Яа¶њ а¶Єа¶ЃаІН඙аІВа¶∞аІНа¶£ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶≠аІВа¶Ѓа¶ња¶Ха¶Њ ඙ඌа¶≤ථ а¶Ха¶∞аІЗа•§ а¶Пඁථа¶ХаІА ඐගබаІНа¶ѓаІБаІО а¶ЄаІНа¶ЂаІБа¶≤а¶ња¶ЩаІНа¶Ч ඙аІНа¶∞а¶ѓа¶ЉаІЛа¶ЧаІЗа¶У а¶ХаІНа¶≤аІЛа¶∞ගථ а¶ђа¶Њ а¶ЂаІНа¶≤аІЛа¶∞ගථаІЗа¶∞ ඪඌඕаІЗ а¶Па¶∞ а¶ХаІЛථ а¶∞ඌඪඃඊථගа¶Х а¶ђа¶ња¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Њ а¶Єа¶Ва¶Ша¶Яගට а¶єа¶ѓа¶Љ а¶®а¶Ња•§ а¶∞аІЗа¶≤аІЗ а¶У а¶Йа¶За¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶∞ඌඪඌඃඊථගа¶Х ථගඣаІНа¶ХаІНа¶∞ගඃඊටඌа¶∞ а¶Ха¶Ња¶∞а¶£аІЗ ථටаІБථ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤аІЗа¶∞ ථඌඁඌа¶Ха¶∞а¶£ а¶Ха¶∞аІЗථ а¶Жа¶∞аІНа¶Чථ а¶ђа¶Њ а¶Еа¶≤а¶Єа•§ а¶ХගථаІНටаІБ ඙а¶∞а¶ђа¶∞аІНටаІАа¶Ха¶Ња¶≤аІЗ ඙аІНа¶∞а¶Ѓа¶Ња¶£а¶ња¶§ а¶єа¶ѓа¶Љ а¶ѓаІЗ, а¶Йа¶ХаІНට а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЕඐපаІЗа¶Ја¶Яа¶њ ඐගපаІБබаІНа¶І а¶Жа¶∞аІНа¶Чථ ථඃඊ а¶Па¶ђа¶В а¶ПටаІЗ а¶Жа¶∞а¶У а¶ђа¶ња¶≠ගථаІНථ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤ а¶∞а¶ѓа¶ЉаІЗа¶ЫаІЗа•§
аІІаІЃаІђаІЃ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗа¶∞ аІІаІЃа¶З а¶Жа¶Ча¶ЄаІНа¶Я ටඌа¶∞а¶ња¶ЦаІЗ а¶Ђа¶∞а¶Ња¶Єа¶њ а¶ЬаІНа¶ѓаІЛටගа¶∞аІНඐගබ а¶ЬඌථඪаІЗථ (Janssen) а¶≠а¶Ња¶∞ටаІЗ බаІГа¶ЈаІНа¶Я ඙аІВа¶∞аІНа¶£ а¶ЄаІВа¶∞аІНа¶ѓ а¶ЧаІНа¶∞а¶єа¶£аІЗа¶∞ а¶Єа¶Ѓа¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЄаІМа¶∞ а¶Жа¶ђа¶∞а¶£аІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶ђа¶∞аІНа¶£а¶Ња¶≤аІА ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞аІЗ а¶Па¶Ха¶Яа¶њ а¶ЄаІН඙ඣаІНа¶Я ඙аІАට а¶∞аІЗа¶Ца¶Њ D3 а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ а¶Ха¶∞аІЗа¶®а•§ а¶Па¶З а¶∞аІЗа¶Ца¶Њ а¶ЄаІЛа¶°а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ D1 а¶У D2 а¶∞аІЗа¶Ца¶Њ ඕаІЗа¶ХаІЗ а¶Єа¶ЃаІН඙аІВа¶∞аІНа¶£ а¶ЄаІНඐටථаІНටаІНа¶∞а•§ ඙а¶∞аІЗ а¶≤а¶Ха¶ња¶ѓа¶Ља¶Ња¶∞ (LocKyer) а¶У а¶ЂаІНа¶∞а¶Ња¶ЩаІНа¶Ха¶≤аІНа¶ѓа¶Ња¶£аІНа¶° (Frankland) а¶ђа¶ња¶ђа¶ња¶І ඙а¶∞аІАа¶ХаІНа¶Ја¶Њ-ථගа¶∞аІАа¶ХаІНа¶Ја¶Ња¶∞ а¶Єа¶Ња¶єа¶Ња¶ѓаІНа¶ѓаІЗ а¶Пඁට ඪගබаІН඲ඌථаІНටаІЗ а¶Й඙ථаІАට යථ а¶ѓаІЗ, а¶ѓаІЗ а¶Йа¶ХаІНට а¶∞аІЗа¶Ца¶Њ а¶ХаІЛථ а¶Е඙ඌа¶∞аІНඕගඐ а¶ЃаІМа¶≤аІЗа¶∞ а¶ЄаІВа¶Ъа¶ХвАФа¶ѓа¶Њ а¶ХаІЗа¶ђа¶≤ а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶ѓа¶Љ а¶ЄаІМа¶∞ а¶Жа¶ђа¶∞а¶£аІЗа¶З ඐගබаІНа¶ѓа¶Ѓа¶Ња¶®а•§ а¶П а¶Ха¶Ња¶∞а¶£аІЗ а¶ЧаІНа¶∞аІАа¶Х вАШа¶єаІЗа¶≤а¶ња¶Уа¶ЄвАЩ (halios-а¶ЄаІВа¶∞аІНа¶ѓ) පඐаІНබඌථаІБа¶ХаІНа¶∞а¶ЃаІЗ а¶Па¶∞ ථඌඁඌа¶Ха¶∞а¶£ а¶Ха¶∞а¶Њ а¶єа¶ѓа¶Љ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ (Helium)а•§
 Helium was first detected in the Sun due to its characteristic spectral lines.
Helium was first detected in the Sun due to its characteristic spectral lines.
а¶Е඙а¶∞ බගа¶ХаІЗ а¶ђа¶ња¶ЬаІНа¶ЮඌථаІА а¶Йа¶За¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶ђа¶Ња¶ѓа¶ЉаІБ а¶Ыа¶Ња¶°а¶Ља¶Њ а¶≠ගථаІНථ а¶ХаІЛථ а¶ЙаІОа¶ЄаІЗ а¶Жа¶∞аІНа¶Чථ ඪථаІН඲ඌථ а¶Еа¶ђаІНඃඌයට а¶∞а¶Ња¶Ца¶≤аІЗа¶®а•§ аІІаІЃаІЃаІЃ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ а¶ђа¶ња¶ЬаІНа¶ЮඌථаІА а¶єа¶ња¶≤аІЗа¶ђаІНа¶∞а¶Ња¶£аІНа¶° (Hillebrand) а¶ХаІНа¶≤а¶ња¶≠а¶Ња¶За¶Я (clevite) ථඌඁа¶Х а¶За¶Йа¶∞аІЗථගඃඊඌඁ а¶Жа¶Ха¶∞а¶ња¶Ха¶ХаІЗ а¶≤а¶ШаІБ а¶Єа¶Ња¶≤а¶Ђа¶ња¶Йа¶∞а¶ња¶Х а¶Па¶Єа¶ња¶°аІЗ а¶ЙටаІНට඙аІНට а¶Ха¶∞аІЗ а¶Жа¶Ха¶∞а¶ња¶ХаІЗ а¶ЕථаІНටа¶∞аІНа¶ІаІГට (occluded) а¶Па¶Ха¶Яа¶њ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Еа¶ЄаІНටගටаІНа¶ђ ඙аІНа¶∞а¶Ѓа¶Ња¶£ а¶Ха¶∞аІЗа¶£а•§ ටගථග а¶Па¶З а¶ЧаІНа¶ѓа¶Ња¶Єа¶ХаІЗ а¶≠аІБа¶≤а¶ХаІНа¶∞а¶ЃаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶ЬаІНа¶Юඌථ а¶Ха¶∞аІЗථ; а¶Ђа¶≤аІЗ ථටаІБථ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗа¶∞ а¶ЧаІМа¶∞а¶ђ а¶≤а¶Ња¶≠аІЗ а¶Еа¶Єа¶Ѓа¶∞аІНඕට а¶єа¶ѓа¶Ља•§ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶єа¶ња¶≤аІЗа¶ђаІНа¶∞а¶Ња¶£аІНа¶°аІЗа¶∞ ඙аІНа¶∞а¶£а¶Ња¶≤аІА а¶ЕථаІБа¶Єа¶Ња¶∞аІЗ а¶ХаІНа¶≤а¶ња¶≠а¶Ња¶За¶Яа¶ХаІЗ а¶≤а¶ШаІБ а¶Єа¶Ња¶≤а¶Ђа¶ња¶Йа¶∞а¶ња¶Х а¶Па¶Єа¶ња¶° а¶Єа¶єа¶ѓаІЛа¶ЧаІЗ а¶ЙටаІНට඙аІНට а¶Х'а¶∞аІЗ ඙аІНа¶∞ඌ඙аІНට а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗ аІ®аІ¶% ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථаІЗа¶∞ а¶Еа¶ЄаІНටගටаІНа¶ђ а¶≤а¶Ња¶≠ а¶Ха¶∞аІЗа¶®а•§ а¶Й඙а¶∞ථаІНටаІБ а¶Ха¶ЄаІНа¶Яа¶ња¶Х а¶ЕаІНа¶ѓа¶Ња¶≤а¶Ха¶Ња¶≤а¶ња¶∞ а¶Й඙а¶∞ ඐගබаІНа¶ѓаІБаІО а¶ЄаІНа¶ЂаІБа¶≤а¶ња¶ЩаІНа¶Ч ඙аІНа¶∞а¶ѓа¶ЉаІЛа¶ЧаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ ඐගබаІВа¶∞ගට а¶Х'а¶∞аІЗ а¶ђа¶∞аІНа¶£а¶Ња¶≤аІА ඐගපаІНа¶≤аІЗа¶Ја¶£аІЗа¶У D3-а¶∞аІЗа¶Ца¶Њ ඙аІНа¶∞ඌ඙аІНට а¶єа¶®а•§ а¶Па¶Яа¶њ а¶Ыа¶ња¶≤ а¶ЬඌථඪаІЗථ а¶Ха¶∞аІНටаІГа¶Х а¶ЧаІНа¶ѓа¶Ња¶ЄаІАа¶∞ а¶ЄаІМа¶∞ а¶Жа¶ђа¶∞а¶£аІЗ ඙аІНа¶∞ඌ඙аІНට D3-а¶∞аІЗа¶Ца¶Њ а¶ђаІНඃටаІАට а¶Жа¶∞ а¶Ха¶ња¶ЫаІБа¶З а¶®а¶ѓа¶Ља•§ а¶Па¶ђаІВ඙аІЗ ඙аІНа¶∞ඕඁ ඙ඌа¶∞аІНඕගඐ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶Жа¶ђа¶ња¶ЈаІНа¶ХаІГට а¶єа¶ѓа¶Ља•§ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶ШථටаІНа¶ђ, ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ а¶У а¶Па¶Х ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Хටඌ ථගа¶∞аІНа¶£аІАට а¶єа¶≤а•§ බаІЗа¶Ца¶Њ а¶ЧаІЗа¶≤ а¶Па¶∞ а¶ШථටаІНа¶ђ а¶У ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ ඃඕඌа¶ХаІНа¶∞а¶ЃаІЗ аІІ.аІѓаІѓ а¶У аІ™а•§
а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶У а¶ЯаІНа¶∞а¶Ња¶≠а¶Ња¶∞аІНа¶Є (Travers) а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶ШථටаІНа¶ђ ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞ටаІЗ а¶Ча¶ња¶ѓа¶ЉаІЗ බаІЗа¶ЦаІЗථ а¶ѓаІЗ а¶ђа¶ња¶≠ගථаІНථ а¶Жа¶Ха¶∞а¶ња¶Х යටаІЗ ඙аІНа¶∞ඌ඙аІНට а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶ШථටаІНа¶ђ а¶ђа¶ња¶≠ගථаІНа¶®а•§ а¶Ха¶Ња¶ЬаІЗа¶З ටඌа¶∞а¶Њ ඙аІНа¶∞ඌ඙аІНට а¶ЧаІНа¶ѓа¶Ња¶Єа¶ХаІЗ а¶ђаІНඃඌ඙ථ (diffusion) ඙аІНа¶∞а¶£а¶Ња¶≤аІАа¶∞ а¶Єа¶Ња¶єа¶Ња¶ѓаІНа¶ѓаІЗ බаІБа¶Яа¶њ а¶Еа¶ВපаІЗ ඙аІГඕа¶Х а¶Ха¶∞аІЗ ටඌබаІЗа¶∞ а¶ШථටаІНа¶ђаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶Йа¶≤аІНа¶≤аІЗа¶Ца¶ѓаІЛа¶ЧаІНа¶ѓ а¶∞а¶Ха¶Ѓ а¶ђаІНඃඐ඲ඌථ ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞аІЗථ, а¶Па¶ђа¶В а¶ђа¶∞аІНа¶£а¶Ња¶≤аІА ඐගපаІНа¶≤аІЗа¶Ја¶£ а¶Ха¶∞аІЗ а¶Е඙аІЗа¶ХаІНа¶Ја¶Ња¶ХаІГට а¶≠а¶Ња¶∞аІА а¶Еа¶Вපа¶ХаІЗ а¶Жа¶∞аІНа¶Чථ а¶У а¶єа¶Ња¶≤аІНа¶Ха¶Њ а¶Еа¶Вපа¶ХаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђа¶≤аІЗ ථගа¶∞аІВа¶™а¶£ а¶Ха¶∞аІЗа¶£а•§ а¶Па¶∞аІВ඙аІЗ а¶Цථගа¶Ь ඙බඌа¶∞аІНඕаІЗ а¶Жа¶∞аІНа¶ЧථаІЗа¶∞ а¶Еа¶Єа¶ња¶ЄаІНටටаІНа¶ђ а¶Жа¶ђа¶ња¶ЈаІНа¶ХаІГට а¶єа¶ѓа¶Ља•§
а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶У а¶Жа¶∞аІНа¶Чථ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗа¶∞ ඙а¶∞ ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶Єа¶Ња¶∞а¶£а¶ња¶§аІЗ ටඌබаІЗа¶∞ а¶Еа¶ђа¶ЄаІНඕඌථ ථගа¶∞аІНа¶ђа¶Ња¶ЪථаІЗ а¶Ьа¶Яа¶ња¶≤ටඌ බаІЗа¶Ца¶Њ බаІЗа¶ѓа¶Ља•§ аІІаІЃаІѓаІђ а¶Єа¶Ња¶≤аІЗ а¶ЬаІБа¶≤а¶ња¶У а¶Яඁඪථ (Juliet Thomson) ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶ЄаІВටаІНа¶∞ ඙аІНа¶∞а¶ѓа¶ЉаІЛа¶Ч а¶Ха¶∞аІЗ ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶Єа¶Ња¶∞а¶£а¶ња¶§аІЗ а¶Па¶Ха¶Яа¶њ පаІВථаІНа¶ѓ-පаІНа¶∞аІЗа¶£аІАа¶∞ ඙аІНа¶∞а¶ЄаІНටඌඐ а¶Ха¶∞аІЗථ а¶Па¶ђа¶В а¶ПටаІЗ аІ™, аІ®аІ¶, аІ©аІ¶, аІЃаІ™, аІІаІ©аІ®, а¶У аІ®аІІаІ® ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶ЧаІБа¶∞аІБටаІНа¶ђаІЗа¶∞ а¶Ыа¶ѓа¶Ља¶Яа¶њ а¶ЃаІМа¶≤ ඕඌа¶Ха¶Ња¶∞ а¶Єа¶ЃаІНа¶≠ඌඐථඌ ඙аІНа¶∞а¶Хඌප а¶Ха¶∞аІЗа¶®а•§ ටඌа¶∞ а¶Па¶З ඙аІНа¶∞а¶ЄаІНටඌඐථඌ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶У а¶ЯаІНа¶∞а¶Ња¶≠а¶Ња¶∞аІНа¶Єа¶ХаІЗ а¶Па¶З පаІВථаІНа¶ѓ පаІНа¶∞аІЗа¶£аІАа¶∞ а¶Е඙а¶∞ඌ඙а¶∞ а¶ЃаІМа¶≤аІЗа¶∞ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗ а¶ЙබаІНа¶ђаІБබаІНа¶І а¶Ха¶∞аІЗа¶®а•§ а¶єа¶ња¶≤ගඃඊඌථ а¶У а¶Жа¶∞аІНа¶Чථ а¶Жа¶ђа¶ња¶ЈаІНа¶ХаІГට а¶єа¶Уа¶ѓа¶Ља¶Ња¶ѓа¶Љ ටඌа¶∞а¶Њ а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ а¶Жа¶∞а¶У а¶ЕථඌඐගඣаІНа¶ХаІГට а¶ЃаІМа¶≤аІЗа¶∞ а¶ЕථаІБඁඌථ а¶Ха¶∞аІЗථ а¶У ටඌබаІЗа¶∞ а¶ЕථаІБඪථаІН඲ඌථаІЗ а¶ђаІНа¶∞ටаІА а¶єа¶®а•§
аІІаІЃаІѓаІЃ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶У а¶ЯаІНа¶∞а¶Ња¶∞аІНа¶≠а¶Ња¶Є ටа¶∞а¶≤ а¶ђа¶Ња¶ѓа¶ЉаІБа¶∞ а¶Жа¶Вපගа¶Х ඙ඌටථаІЗ ඙аІНа¶∞ඌ඙аІНට ටа¶∞а¶≤ а¶Жа¶∞аІНа¶ЧථаІЗа¶∞ ඙аІБථа¶Г а¶Жа¶Вපගа¶Х ඙ඌටථ а¶Ха¶∞аІЗ а¶Еа¶Іа¶ња¶Х а¶ЙබаІНа¶ђа¶Ња¶ѓа¶ЉаІА а¶Еа¶Вප යටаІЗ а¶Па¶Ха¶Яа¶њ а¶ЧаІНа¶ѓа¶Ња¶Є ඙аІГඕа¶Х а¶Ха¶∞аІЗථ а¶У ටඌа¶∞ а¶ђа¶£а¶Ња¶≤аІА ඐගපаІНа¶≤аІЗа¶Ја¶£ а¶Ха¶∞аІЗ а¶Жа¶∞ а¶Па¶Ха¶Яа¶њ ථටаІБථ а¶ЧаІНа¶ѓа¶Ња¶Є ථගඃඊථ (а¶Еа¶∞аІНඕඌаІО вАШථටаІБථвАЩ) а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ а¶Ха¶∞аІЗа¶®а•§ а¶Па¶∞ а¶ШථටаІНа¶ђ а¶У а¶Жа¶£а¶ђа¶ња¶Х а¶≠а¶ѓа¶Љ ඃඕඌа¶ХаІНа¶∞а¶ЃаІЗ аІІаІ¶.аІІ а¶У аІ®аІ®.аІ® а¶Па¶ђа¶В а¶Па¶Яа¶ња¶У а¶Па¶Х-඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Ха•§ ඙а¶∞аІЗ ටඌа¶∞а¶Њ а¶Ха¶Ѓ а¶ЙබаІНа¶ђа¶Ња¶ѓа¶ЉаІА а¶Еа¶Вප යටаІЗ ඙аІГඕа¶Ха¶≠а¶Ња¶ђаІЗ බаІБа¶Яа¶њ ථටаІБථ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є ඃඕඌ а¶ХаІНа¶∞ග඙а¶Яථ (а¶Еа¶∞аІНඕඌаІО а¶ЧаІБ඙аІНට) а¶У а¶ЬаІЗථථ (а¶Еа¶∞аІНඕඌаІО а¶Жа¶ЧථаІНටаІБа¶Х) а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ а¶Ха¶∞аІЗа¶®а•§
а¶Па¶Х а¶Ха¶ѓа¶ЉаІЗа¶Х а¶ђа¶Ыа¶∞ ඙а¶∞ аІІаІѓаІ¶аІ¶ а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ а¶∞аІНධථ (Dorn) а¶∞аІЗа¶°а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ХаІНа¶Ја¶ѓа¶Ља¶Ьඌට ඙බඌа¶∞аІНඕ යටаІЗ а¶Єа¶∞аІНඐපаІЗа¶Ј ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶∞аІЗධථ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ а¶Ха¶∞а¶®а•§ аІЃаІЃ/аІ®аІ®аІ® а¶Ьа¶І аІЃаІђ/аІ®аІ®аІ® а¶Ьа¶є + аІ®/аІ™ а¶Ра¶ђ
аІІаІѓаІ¶аІ© а¶ЦаІНа¶∞а¶ња¶ЈаІНа¶Яа¶Ња¶ђаІНබаІЗ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ а¶У а¶Єа¶°а¶њ (Soddy) а¶∞аІЗа¶°а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ђа¶ња¶≠а¶Ња¶ЬථаІЗа¶∞ а¶Ђа¶≤аІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඙аІНа¶∞ඌ඙аІНට යථ а¶Па¶ђа¶В බаІЗа¶Ца¶Њ а¶ѓа¶Ња¶ѓа¶Љ а¶ЕථаІЗа¶Х ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЃаІМа¶≤ යටаІЗа¶З а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђа¶ња¶ЪаІНа¶ЫаІБа¶∞ගට а¶єа¶ѓа¶Ља•§
а¶Па¶За¶≠а¶Ња¶ђаІЗ а¶ЄаІНа¶ѓа¶Ња¶∞ а¶Йа¶За¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶∞вАНаІНа¶ѓа¶Ња¶Ѓа¶Ьа¶њ'а¶∞ ථගа¶∞а¶≤а¶Є, ථග඙аІБа¶£ а¶У а¶ЄаІБබаІАа¶∞аІНа¶Ш а¶Ча¶ђаІЗа¶Ја¶£а¶Ња¶∞ а¶Ђа¶≤аІЗ а¶Па¶Ха¶Яа¶њ පаІНа¶∞аІЗа¶£аІАа¶∞ а¶Єа¶ђ а¶Ха¶ѓа¶Ља¶Яа¶њ а¶ЃаІМа¶≤а¶З а¶Па¶ХаІЗа¶∞ ඙а¶∞ а¶Па¶Х а¶Жа¶ђа¶ња¶ЈаІНа¶ХаІГට а¶єа¶ѓа¶Ља•§[аІ©]
а¶Еа¶ђа¶ЄаІНඕඌථ а¶У а¶ЙаІОа¶Є
- а¶Па¶ХඁඌටаІНа¶∞ а¶∞вАМаІНඃඌධථ а¶ђаІНඃටаІАට а¶Єа¶ђ а¶Х'а¶Яа¶њ ථගඣаІНа¶ХаІНа¶∞аІАа¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Єа¶З а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ а¶ђа¶∞аІНа¶§а¶Ѓа¶Ња¶®а•§ ටඐаІЗ а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ а¶ПබаІЗа¶∞ а¶Єа¶∞аІНа¶ђа¶ЃаІЛа¶Я ඙а¶∞а¶ња¶Ѓа¶Ња¶£ а¶Єа¶∞аІНа¶ђаІНа¶ђаІЛа¶ЪаІНа¶Ъ аІІ.аІ¶% ඁඌටаІНа¶∞а•§ а¶Па¶ЬථаІНа¶ѓ а¶ПබаІЗа¶∞а¶ХаІЗ а¶ђа¶ња¶∞а¶≤ а¶ЧаІНа¶ѓа¶Ња¶Є (rare gases) ථඌඁаІЗа¶У а¶Еа¶≠ගයගට а¶Ха¶∞а¶Њ а¶єа¶ѓа¶Ља•§
- а¶Цථගа¶Ь ඙බඌа¶∞аІНඕа¶Г а¶За¶Йа¶∞аІЗථගථඌа¶За¶Я (Uraninite), а¶ЃаІЛථඌа¶Ьа¶Ња¶За¶Я (Monazite) ඕаІЛа¶∞ගඃඊඌථඌа¶За¶Я (Thorianite), а¶ХаІНа¶≤а¶ња¶≠а¶Ња¶За¶Я (Cleveite), а¶ђаІЗа¶∞а¶ња¶≤ (Beryl), а¶Ха¶∞аІНа¶°а¶ња¶∞а¶Ња¶За¶Я (Cordierite), ඙ගа¶Ъ а¶ђаІНа¶≤аІЗа¶£аІНа¶° (Pitch blende) а¶ЗටаІНඃඌබග а¶Ха¶ња¶ЫаІБ а¶Жа¶Ха¶∞а¶ња¶ХаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶У а¶Ха¶ња¶ЫаІБ ඙а¶∞а¶ња¶Ѓа¶Ња¶£ а¶Жа¶∞аІНа¶Чථ а¶ЖඐබаІНа¶І а¶Еа¶ђа¶ЄаІНඕඌඃඊ ඕඌа¶ХаІЗа•§ ටඌ඙඙аІНа¶∞а¶ѓа¶ЉаІЛа¶ЧаІЗ а¶Жа¶Ха¶∞а¶ња¶Х ඕаІЗа¶ХаІЗ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ђаІЗа¶∞а¶ња¶ѓа¶ЉаІЗ а¶Жа¶ЄаІЗа•§
- ඙аІНа¶∞а¶Ња¶ХаІГටගа¶Х а¶ЧаІНа¶ѓа¶Ња¶Єа¶Г ඙аІЗа¶ЯаІНа¶∞аІЛа¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ටаІИа¶≤а¶ХаІВ඙ ඕаІЗа¶ХаІЗ ඙аІНа¶∞ඌ඙аІНට ඙аІНа¶∞а¶Ња¶ХаІГටගа¶Х а¶ЧаІНа¶ѓа¶Ња¶Є (඙аІНа¶∞඲ඌථට ඁගඕаІЗථ) а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶Па¶Ха¶Яа¶њ а¶ЧаІБа¶∞аІБටаІНඐ඙аІВа¶∞аІНа¶£ а¶ЙаІОа¶Єа•§ а¶ПටаІЗ аІ¶.аІЂ ඕаІЗа¶ХаІЗ аІІ.аІЂ පටඌа¶Вප ඙а¶∞аІНඃඌථаІНට а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඐගබаІНа¶ѓа¶Ѓа¶Ња¶®а•§
- а¶Єа¶ЃаІБබаІНа¶∞ а¶У а¶Эа¶∞аІНа¶£а¶Ња¶∞ ඙ඌථගа¶Г а¶Єа¶ЃаІБබаІНа¶∞ ඙ඌථගටаІЗ а¶ђа¶Ња¶ѓа¶ЉаІБа¶Ѓа¶£аІНа¶°а¶≤аІАа¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є බаІНа¶∞а¶ђаІАа¶≠аІВට ඕඌа¶ХаІЗ а¶ђа¶ња¶Іа¶Ња¶ѓа¶Љ а¶ПටаІЗ а¶Еа¶≤аІН඙ ඙а¶∞а¶ња¶Ѓа¶Ња¶£ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є ඙ඌа¶Уа¶ѓа¶Ља¶Њ а¶ѓа¶Ња¶ѓа¶Ља•§ а¶Ха¶ЦථаІЛ а¶Ха¶ЦථаІЛ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ а¶Эа¶∞аІНа¶£а¶Ња¶∞ ඙ඌථගටаІЗ බаІНа¶∞а¶ђаІАа¶≠аІВට а¶Еа¶ђа¶ЄаІНඕඌඃඊ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඐගබаІНඃඁඌථ ඕඌа¶ХаІЗа•§ а¶ѓаІЗඁථ Bourbon-lancy ථඌඁа¶Х а¶Эа¶∞аІНа¶£а¶Ња¶∞ а¶Цථගа¶Ь ඙ඌථගටаІЗ аІІ.аІЃаІ™ පටඌа¶Вප ඙а¶∞а¶ња¶Ѓа¶Ња¶£аІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඙ඌа¶Уа¶ѓа¶Ља¶Њ а¶ѓа¶Ња¶ѓа¶Ља•§ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶Па¶Ха¶Яа¶њ а¶Йа¶≤аІНа¶≤аІЗа¶Ца¶ѓаІЛа¶ЧаІНа¶ѓ а¶ЙаІОа¶Є а¶Па¶З а¶Цථගа¶Ь а¶™а¶Ња¶®а¶ња•§
- а¶∞аІЗа¶°а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ђа¶ња¶≠а¶Ња¶Ьථ а¶∞вАМаІНඃඌධථ а¶Па¶Ха¶Яа¶њ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ (radioactive) а¶ЃаІМа¶≤а•§ а¶∞аІЗа¶°а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ХаІНа¶Ја¶ѓа¶ЉаІЗа¶∞ (radioactive decay) а¶Ђа¶≤аІЗ а¶ЙаІО඙ථаІНථ а¶∞вАМаІНඃඌධථ а¶ЕථаІЗа¶Х а¶Єа¶Ѓа¶ѓа¶Љ а¶ђа¶Ња¶ѓа¶ЉаІБа¶Ѓа¶£аІНа¶°а¶≤аІЗ ඙ඌа¶Уа¶ѓа¶Ља¶Њ а¶ѓа¶Ња¶ѓа¶Ља•§
| Abundance |
Helium |
Neon |
Argon |
Krypton |
Xenon |
Radon
|
| Solar System (for each atom of silicon)[аІ™] |
2343 |
2.148 |
0.1025 |
5.515 √Ч 10вИТ5 |
5.391 √Ч 10вИТ6 |
вАУ
|
| Earth's atmosphere (volume fraction in ppm)[аІЂ] |
5.20 |
18.20 |
9340.00 |
1.10 |
0.09 |
(0.06вАУ18) √Ч 10вИТ19[аІђ]
|
| Igneous rock (mass fraction in ppm)[аІ≠] |
3 √Ч 10вИТ3 |
7 √Ч 10вИТ5 |
4 √Ч 10вИТ2 |
вАУ |
вАУ |
1.7 √Ч 10вИТ10
|
а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є а¶У а¶∞ඌඪඌඃඊථගа¶Х ථගඣаІНа¶ХаІНа¶∞ගඃඊටඌ
ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞а¶≤аІЗ බаІЗа¶Ца¶Њ а¶ѓа¶Ња¶ѓа¶Љ а¶ѓаІЗ, ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Єа¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶ЄаІНඕ පа¶ХаІНටගඪаІНටа¶∞ а¶ЕථаІБа¶ЃаІЛබගට а¶Єа¶Ва¶ЦаІНа¶ѓа¶Х а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ බаІНа¶ђа¶Ња¶∞а¶Њ ඙аІВа¶∞аІНа¶£ а¶Па¶ђа¶В а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථа¶ЧаІБа¶≤аІЛ ඐග඙а¶∞аІАටඁаІБа¶ЦаІА а¶ЄаІН඙ගථඪය а¶ЬаІЛа¶°а¶Ља¶Ња¶ѓа¶Љ а¶ЬаІЛа¶°а¶Ља¶Ња¶ѓа¶Љ а¶Єа¶ЬаІНа¶Ьа¶ња¶§а•§ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶ђа¶єа¶ња¶Га¶ЄаІНඕ පа¶ХаІНටග а¶ЄаІНටа¶∞аІЗ s а¶Еа¶∞аІНа¶ђа¶ња¶Яа¶Ња¶≤аІЗ බаІБа¶Яа¶њ, а¶Па¶ђа¶В а¶ЕථаІНа¶ѓ а¶Єа¶Ха¶≤ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶ЄаІНඕ පа¶ХаІНටග а¶ЄаІНටа¶∞аІЗ s а¶У p а¶Еа¶∞аІНа¶ђа¶ња¶Яа¶Ња¶≤аІЗ а¶ЃаІЛа¶Я а¶Ъа¶Ња¶∞ а¶ЬаІЛа¶°а¶Ља¶Ња¶ѓа¶Љ а¶Жа¶Яа¶Яа¶њ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Жа¶ЫаІЗа•§ а¶ђа¶Ња¶За¶∞аІЗа¶∞ පа¶ХаІНටග а¶ЄаІНටа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ බаІНа¶ђа¶Ња¶∞а¶Њ а¶Єа¶ЃаІН඙аІГа¶ХаІНට а¶ђа¶≤аІЗ а¶Па¶∞а¶Њ а¶∞ඌඪඌඃඊථගа¶Ха¶≠а¶Ња¶ђаІЗ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Ља•§ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Па¶∞аІВ඙ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є а¶ЦаІБа¶ђа¶З а¶ЄаІБа¶ЄаІНඕගට а¶Па¶ђа¶В а¶∞ඌඪඌඃඊථගа¶Х а¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Њ а¶ђа¶∞аІНа¶Ьа¶ња¶§а•§ а¶ПබаІЗа¶∞ а¶ЖඃඊථаІАа¶Ха¶∞а¶£ а¶ђа¶ња¶≠а¶ђаІЗа¶∞ а¶Йа¶ЪаІНа¶Ъඁඌථа¶У а¶П ඪටаІНа¶ѓа¶ХаІЗ ඙а¶∞а¶ња¶ЄаІНа¶ЂаІБа¶Я а¶Ха¶∞аІЗа•§ а¶Ђа¶≤аІЗ а¶Па¶∞а¶Њ а¶Е඙а¶∞ а¶ХаІЛථ а¶ЃаІМа¶≤аІЗа¶∞ а¶Єа¶ЩаІНа¶ЧаІЗ а¶∞ඌඪඌඃඊථගа¶Х а¶ђа¶ња¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Њ බаІВа¶∞аІЗа¶∞ а¶Хඕඌ, а¶Па¶∞а¶Њ ථගа¶ЬаІЗබаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗа¶У а¶ђа¶ња¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Њ а¶Ха¶∞аІЗ බаІНа¶ђа¶њ-඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Х а¶Еа¶£аІБ а¶Чආථ а¶Ха¶∞ටаІЗ ඙ඌа¶∞аІЗ а¶®а¶Ња•§
ථගඁаІНථаІЗ а¶ПබаІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є බаІЗа¶Цඌථ а¶єа¶≤-
| а¶ЃаІМа¶≤ |
඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶Єа¶Ва¶ЦаІНа¶ѓа¶Њ |
а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є |
а¶ѓаІЛа¶ЬаІНඃටඌ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ[аІЃ]
|
| He |
аІ® |
1s2 |
1s2
|
| Ne |
аІІаІ¶ |
[He] 2s2 2p6 |
2s2 2p6
|
| Ar |
аІІаІЃ |
[Ne] 3s2 3p6 |
3s2 3p6
|
| Kr |
аІ©аІђ |
[Ar] 3d10 4s2 4p6 |
4s2 4p6
|
| Xe |
аІЂаІ™ |
[Kr] 4d10 5s2 5p6 |
5s2 5p6
|
| Rn |
аІЃаІђ |
[Xe] 4f14 5d10 6s2 6p6 |
6s2 6p6
|
а¶Іа¶∞аІНа¶Ѓ
а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ, ථගඃඊඁ, а¶Жа¶∞аІНа¶Чථ, а¶ХаІНа¶∞ග඙а¶Яථ, а¶ЬаІЗථථ а¶У а¶∞вАМаІНඃඌධථ-а¶Па¶∞а¶Њ а¶Єа¶Ха¶≤аІЗа¶З а¶ђа¶∞аІНа¶£а¶єаІАථ а¶У а¶ЧථаІНа¶Іа¶єаІАථ а¶ЧаІНа¶ѓа¶Ња¶Єа•§ а¶ПබаІЗа¶∞ ටа¶∞а¶≤аІАа¶Ха¶∞а¶£ а¶ђаІЗප а¶Ха¶ЈаІНа¶Я ඪඌ඙аІЗа¶ХаІНа¶Ја•§ а¶Па¶∞а¶Њ ඙ඌථගටаІЗ ඪඌඁඌථаІНа¶ѓ ඙а¶∞а¶ња¶Ѓа¶Ња¶£аІЗ බаІНа¶∞а¶ђа¶£аІАа¶ѓа¶Љ ( ( 293 k-а¶П L-а¶П 8-40 mL)а•§ ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ а¶ђаІГබаІНа¶Іа¶ња¶∞ ඪඌඕаІЗ ඙ඌථගටаІЗ а¶ПබаІЗа¶∞ බаІНа¶∞а¶Ња¶ђаІНඃටඌ а¶ђаІГබаІНа¶Іа¶њ а¶™а¶Ња¶ѓа¶Ља•§
ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ පаІБа¶ІаІБඁඌටаІНа¶∞ а¶≠аІМට පа¶ХаІНටග (а¶ѓаІЗඁථ Van der WaalsвАЩ forces) ඕඌа¶ХටаІЗ ඙ඌа¶∞аІЗ а¶ђа¶≤аІЗ а¶ПබаІЗа¶∞ а¶ЄаІНа¶ЂаІБа¶Яථඌа¶ЩаІНа¶Х а¶У а¶Ча¶≤ථඌа¶ЩаІНа¶Х а¶Еටගපඃඊ а¶Ха¶Ѓа•§ а¶ПබаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ ටඕඌ а¶Єа¶Ѓа¶ЄаІНට а¶ЬаІНа¶Юඌට а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶Ча¶≤ථඌа¶Ва¶Х а¶У а¶ЄаІНа¶ЂаІБа¶Яථඌа¶ЩаІНа¶Х а¶Єа¶ђа¶ЪаІЗа¶ѓа¶ЉаІЗ а¶Ха¶Ѓа•§ а¶ЧаІНа¶ѓа¶Ња¶Єа¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ බаІЗа¶Ца¶Њ а¶ѓа¶Ња¶ѓа¶Љ ටඌබаІЗа¶∞ а¶Ча¶≤ථඌа¶Ва¶Х а¶У а¶ЄаІНа¶ЂаІБа¶Яථඌа¶ЩаІНа¶Х ටඌබаІЗа¶∞ ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ а¶ђаІГබаІНа¶Іа¶ња¶∞ ඪඌඕаІЗ а¶ђаІГබаІНа¶Іа¶њ а¶™а¶Ња¶ѓа¶Ља•§
а¶ЕථаІНඃඌථаІНа¶ѓ පаІНа¶∞аІЗа¶£аІАа¶∞ а¶ЃаІМа¶≤аІЗа¶∞ ටаІБа¶≤ථඌа¶∞ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤аІЗа¶∞ а¶ЖඃඊථаІАа¶Ха¶∞а¶£ а¶ђа¶ња¶≠а¶ђ (ionisation potential) а¶ЕථаІЗа¶Х а¶ђаІЗа¶ґа¶ња•§ ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶≠а¶∞ а¶ђаІГථаІНа¶Іа¶ња¶∞ ඪඌඕаІЗ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶ЖඃඊථаІАа¶Ха¶∞а¶£ а¶ђа¶ња¶≠а¶ђ а¶єаІНа¶∞а¶Ња¶Є а¶™а¶Ња¶ѓа¶Ља•§ а¶ПබаІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Жа¶Єа¶ХаІНටග (electron affinity) පаІВථаІНа¶ѓаІЗа¶∞ а¶Ха¶Ња¶Ыа¶Ња¶Ха¶Ња¶Ыа¶ња•§ а¶Па¶∞а¶Њ а¶Єа¶Ха¶≤аІЗа¶З а¶Па¶Х ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶Ха•§ а¶Ж඙аІЗа¶ХаІНа¶Ја¶ња¶Х ටඌ඙аІЗа¶∞ а¶ЕථаІБ඙ඌට Y=Cp/Cu=аІІ.аІђаІ≠(а¶ЄаІНඕаІВа¶≤ටඌ)а•§
ථගа¶ЪаІЗа¶∞ а¶Ыа¶ХаІЗ а¶ПබаІЗа¶∞ а¶Ха¶ѓаІЗа¶Ха¶Яа¶њ а¶≠аІМට а¶Іа¶∞аІНа¶Ѓ а¶Єа¶Ња¶∞а¶£а¶ња¶ђа¶¶аІНа¶І а¶Ха¶∞а¶Њ а¶єа¶≤аІЛа¶Г
а¶∞ඌඪඌඃඊථගа¶Х а¶Іа¶∞аІНа¶Ѓ
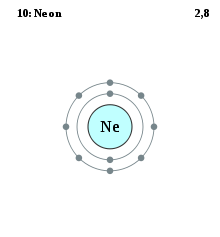 Neon, like all noble gases, has a full valence shell
Neon, like all noble gases, has a full valence shell
඙аІНа¶∞ටаІНа¶ѓаІЗа¶Х ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶ЄаІНඕ පа¶ХаІНටග-а¶ЄаІНටа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ බаІНа¶ђа¶Ња¶∞а¶Њ ඙аІВа¶∞аІНа¶£ (ns2np6) а¶Еа¶∞аІНඕඌаІО а¶ПබаІЗа¶∞ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶ЄаІНඕ а¶ЄаІНටа¶∞аІЗ аІ™а¶Яа¶њ а¶Ха¶∞аІЗ (He-а¶Па¶∞ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ аІ® а¶Яа¶њ) а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Жа¶ЫаІЗа•§ а¶ПබаІЗа¶∞ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞аІЗ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ බඌථ (donate) а¶ђа¶Њ а¶ЧаІНа¶∞а¶єа¶£ (accept ) а¶Ха¶∞а¶Ња¶∞ а¶ХаІЛථа¶∞аІВ඙ ඙аІНа¶∞а¶ђа¶£а¶§а¶Њ බаІЗа¶Ца¶Ња¶ѓа¶Љ ථඌ а¶ђа¶≤аІЗ а¶Па¶∞а¶Њ а¶ЖඃඊථаІАа¶ѓа¶Љ а¶ђа¶Њ а¶Єа¶Ѓа¶ѓаІЛа¶ЬаІА (covalent) а¶ѓаІМа¶Ч а¶Чආථ а¶Ха¶∞ටаІЗ ඙ඌа¶∞аІЗ а¶®а¶Ња•§ а¶ЕටටаІНа¶∞а¶ђ а¶Па¶∞а¶Њ а¶Єа¶ЃаІН඙аІВа¶∞аІНа¶£а¶∞аІВ඙аІЗ а¶∞ඌඪඌඃඊථගа¶Х а¶ХаІНа¶∞а¶ња¶ѓа¶Ља¶Ња¶єаІАа¶®а•§ а¶ПටබаІНඪටаІНටаІНа¶ђаІЗа¶У ඐගපаІЗа¶Ј а¶ХаІЛථ а¶ХаІЛථ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶Ха¶∞аІНටаІГа¶Х а¶ђа¶ња¶≠ගථаІНථ а¶ѓаІМа¶Ч а¶ЧආථаІЗа¶∞ ඙аІНа¶∞а¶Ѓа¶Ња¶£ ඙ඌа¶Уа¶ѓа¶Ља¶Њ а¶ЧаІЗа¶ЫаІЗа•§
а¶ЧаІБа¶∞аІБටаІНа¶ђ
ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶ЧаІБа¶∞аІБටаІНа¶ђ а¶ЕථаІЗа¶Ха•§ ටටаІНටаІНа¶ђаІАа¶ѓа¶Љ а¶∞ඪඌඃඊථаІЗ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞ ඐගපаІЗа¶Ј а¶ЧаІБа¶∞аІБටаІНඐ඙аІВа¶∞аІНа¶£ а¶≠аІВа¶Ѓа¶ња¶Ха¶Њ ඐයථ а¶Ха¶∞аІЗа•§ ටටаІНටаІНа¶ђаІАа¶ѓа¶Љ а¶∞ඪඌඃඊථаІЗа¶∞ а¶ХаІЛථ බගа¶Х ථаІЗа¶З а¶ѓа¶Њ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗа¶∞ а¶Ђа¶≤аІЗ ඙аІНа¶∞а¶≠ඌඐඌථаІНඐගට а¶єа¶ѓа¶Ља¶®а¶ња•§ а¶ПබаІЗа¶∞ а¶ЕථаІЗа¶Х а¶ЕඐබඌථаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ ථගඁаІНථаІЗа¶∞ а¶Ха¶ѓа¶ЉаІЗа¶Ха¶Яа¶њ ඙аІНа¶∞а¶£а¶ња¶Іа¶Ња¶®а¶ѓаІЛа¶ЧаІНа¶ѓа•§
- ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶Єа¶Ња¶∞а¶£а¶ња¶§аІЗа¶Г ඙а¶∞аІНа¶ѓа¶Ња¶ѓа¶Љ а¶Єа¶Ња¶∞а¶£а¶ња¶§аІЗ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶Еа¶ђа¶ЄаІНඕඌථ ටаІАа¶ђаІНа¶∞ ටධඊගаІОа¶Ла¶£а¶Ња¶§аІНа¶Ѓа¶Х а¶єаІНа¶ѓа¶Ња¶≤аІЛа¶ЬаІЗථ а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ ඙а¶∞аІЗа¶З (аІІаІ≠) а¶ЕථаІНඃබගа¶ХаІЗ, аІІа¶Ѓ පаІНа¶∞аІЗа¶£аІАа¶∞ ටаІАа¶ђаІНа¶∞ ඲ථඌටаІНа¶Ѓа¶Х а¶ХаІНа¶Ја¶Ња¶∞ ඲ඌටаІБ а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Жа¶ЧаІЗ а¶∞а¶ѓа¶ЉаІЗа¶ЫаІЗа•§ а¶Еа¶Ха¶ЄаІНа¶Ѓа¶ЊаІО а¶Па¶З а¶Іа¶∞аІНа¶Ѓ ඙а¶∞а¶ња¶ђа¶∞аІНටථаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶Па¶Ха¶Яа¶Њ а¶ђа¶ња¶∞а¶Ња¶Я а¶Еа¶Єа¶Ња¶Ѓа¶ЮаІНа¶Ьа¶ЄаІНඃටඌ බаІГа¶ЈаІНа¶Я а¶єа¶ѓа¶Ља•§ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞аІЗа¶∞ а¶Ђа¶≤аІЗ ටඌබаІЗа¶∞а¶ХаІЗ පаІВථаІНа¶ѓ (аІ¶) පаІНа¶∞аІЗа¶£аІАටаІЗ (а¶ЃаІЗථаІНа¶°аІЗа¶≤а¶ња¶Ђ а¶ЕථаІБа¶ѓа¶Ња¶ѓа¶ЉаІА) а¶ЄаІНඕඌ඙ථ а¶Ха¶∞а¶Ња¶ѓа¶Љ а¶Па¶З බаІБа¶З ඐග඙а¶∞аІАට඲а¶∞аІНа¶ЃаІА а¶ЃаІМа¶≤ පаІНа¶∞аІЗа¶£аІАа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶ЄаІЗටаІБඐථаІНа¶І а¶∞а¶Ъගට а¶єа¶ѓа¶ЉаІЗа¶ЫаІЗ а¶Па¶ђа¶В а¶Еа¶Єа¶Ња¶Ѓа¶ЮаІНа¶Ьа¶ЄаІНඃටඌ а¶ШаІБа¶ЪаІЗ ඪඁථаІНа¶ђа¶ѓа¶Љ а¶Ша¶ЯаІЗа¶ЫаІЗа•§
- ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х а¶ЧආථаІЗа¶Г а¶Па¶ХඁඌටаІНа¶∞ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђаІНඃටаІАට а¶Єа¶ђ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ පаІЗа¶Ј а¶Ха¶ХаІНа¶ЈаІЗ а¶Жа¶Яа¶Яа¶њ (аІЃ а¶Ха¶∞аІЗ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Жа¶ЫаІЗа•§ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶ЃаІЗа¶∞ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ а¶Па¶З а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Єа¶Ва¶ЦаІНа¶ѓа¶Њ аІ®а¶Яа¶ња•§ а¶ПටаІЗ а¶ђаІЛа¶∞ а¶У а¶ђаІБа¶∞а¶њ (Bury) а¶Па¶З ටටаІНටаІНа¶ђ ඙аІНа¶∞а¶ХඌපаІЗ а¶Єа¶ХаІНа¶Ја¶Ѓ යථ а¶ѓаІЗ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶Га¶ЄаІНඕ а¶ЄаІНටа¶∞ аІЃа¶Яа¶ња¶∞ а¶Еа¶Іа¶ња¶Х а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶Іа¶Ња¶∞а¶£ а¶Ха¶∞ටаІЗ ඙ඌа¶∞аІЗ а¶®а¶Ња•§
- а¶ѓаІЛа¶ЬаІНඃටඌа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ගථаІАа¶ѓа¶Љ ටටаІНටаІНа¶ђ : ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ ඐගථаІНа¶ѓа¶Ња¶Є ඙а¶∞аІНа¶ѓа¶ђаІЗа¶ХаІНа¶Ја¶£ а¶Ха¶∞ට: а¶≤аІБа¶З (Lewis) а¶У а¶ХаІЛа¶ЄаІЗа¶≤ (Kossel) ඙а¶∞а¶Ѓа¶Ња¶£аІБටаІЗ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථаІЗа¶∞ а¶≠а¶Ња¶∞а¶Єа¶Ња¶ЃаІНа¶ѓа¶ЃаІВа¶≤а¶Х ඐගථаІНа¶ѓа¶Ња¶Є а¶Іа¶Ња¶∞а¶£а¶Њ (stable configuration concept) ඙аІНа¶∞а¶ЄаІНටඌඐ а¶Ха¶∞аІЗа¶®а•§ ටඌබаІЗа¶∞ ඙аІНа¶∞ටаІНа¶ѓаІЗа¶Х а¶ЃаІМа¶≤а¶З ටඌа¶∞ ඙а¶∞а¶Ѓа¶Ња¶£аІБа¶∞ а¶Єа¶∞аІНа¶ђа¶ђа¶єа¶ња¶∞а¶ња¶ЄаІНඕ а¶ЄаІНටа¶∞аІЗ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ а¶ЄаІНඕඌථඌථаІНටа¶∞ (а¶ЖඃඊථаІАа¶ѓа¶Љ ඐථаІН඲ථ) а¶ђа¶Њ පаІЗа¶ѓа¶Ља¶Ња¶∞ (а¶Єа¶Ѓа¶ѓаІЛа¶ЬаІА ඐථаІН඲ථ) а¶Ха¶∞аІЗ ටඌа¶∞ ථගа¶Ха¶Яටඁ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ-ඐගථаІНа¶ѓа¶Ња¶Є а¶Еа¶∞аІНа¶Ьථ а¶Ха¶∞аІЗа•§ а¶Еටа¶Па¶ђ, а¶Па¶Ха¶Яа¶њ а¶ЃаІМа¶≤ ටඌа¶∞ ථගа¶Ха¶Яටඁ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ЃаІМа¶≤аІЗа¶∞ а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථаІАа¶ѓа¶Љ а¶Чආථ а¶Еа¶∞аІНа¶Ьථ а¶Ха¶≤аІН඙аІЗ ඃට а¶Єа¶Ва¶ЦаІНа¶ѓа¶Х а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞ථ බඌථ, а¶ЧаІНа¶∞а¶єа¶£ а¶ђа¶Њ а¶≠а¶Ња¶Ча¶Ња¶≠а¶Ња¶Ча¶њ а¶Ха¶∞аІЗ ඕඌа¶ХаІЗ ටඌа¶ХаІЗ а¶ЃаІМа¶≤а¶Яа¶ња¶∞ а¶ѓаІЛа¶ЬаІНඃටඌ а¶ђа¶≤аІЗа•§
- ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞ගඃඊටඌඃඊа¶Г ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЃаІМа¶≤ යටаІЗ ќ±-а¶Ха¶£а¶Њ а¶ђа¶ња¶ЪаІНа¶ЫаІБа¶∞ගට а¶єа¶ѓа¶Ља•§ а¶Па¶Яа¶Њ ඲ථඌටаІНа¶Ѓа¶Х බаІНа¶ђа¶њ-а¶Ж඲ඌථ а¶ѓаІБа¶ХаІНට а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඙а¶∞а¶Ѓа¶Ња¶£аІБ (4He2+)а•§ а¶Па¶З ටඕаІНа¶ѓ ටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ђа¶ња¶≠а¶Ња¶Ьථ ටටаІНටаІНа¶ђ а¶У පаІНа¶∞аІЗа¶£аІА а¶Е඙ඪඌа¶∞а¶£ а¶ЄаІВටаІНа¶∞ (group displacement law) а¶Єа¶Ва¶ђа¶Ъථඌඃඊ а¶Єа¶Ња¶єа¶Ња¶ѓаІНа¶ѓ а¶Ха¶∞аІЗа•§
- а¶Жа¶За¶ЄаІЛа¶ЯаІЛ඙ а¶Жа¶ђа¶ња¶ЈаІНа¶Ха¶Ња¶∞а¶Г а¶ЕටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЃаІМа¶≤а¶Єа¶ЃаІВа¶єаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ ථගඃඊථаІЗа¶∞ а¶Жа¶За¶ЄаІЛа¶ЯаІЛ඙ а¶Єа¶∞аІНඐ඙аІНа¶∞ඕඁ ඙аІГඕа¶Х а¶Ха¶∞а¶Њ а¶єа¶ѓа¶Ља•§ а¶ПටаІЗ а¶Е඙а¶∞ඌ඙а¶∞ а¶ЕටаІЗа¶Ьа¶ЄаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЃаІМа¶≤аІЗа¶∞ а¶Жа¶За¶ЄаІЛа¶ЯаІЛ඙ ඙аІГඕа¶ХаІАа¶Ха¶∞а¶£аІЗа¶∞ ඙аІНа¶∞а¶ЪаІЗа¶ЈаІНа¶Яа¶Њ а¶Ъа¶≤аІЗа•§
а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞
а¶ђа¶ња¶≠ගථаІНථ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ а¶ЧаІНа¶ѓа¶Ња¶ЄаІЗа¶∞ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ ථගඁаІНථаІЗ а¶ђа¶∞аІНа¶£а¶®а¶Њ а¶Ха¶∞а¶Њ а¶єа¶≤аІЛа¶Г
а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ
(аІІ) а¶ђаІЗа¶≤аІБථ а¶У а¶Жа¶Хඌප ඃඌථаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§ а¶Па¶Яа¶њ а¶єа¶Ња¶За¶°аІНа¶∞аІЛа¶ЬаІЗථ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ а¶≠а¶Ња¶∞аІА а¶єа¶≤аІЗа¶У а¶Па¶∞ а¶ЙටаІНටаІЛа¶≤ථ а¶ХаІНඣඁටඌ а¶єа¶Ња¶За¶°аІНа¶∞аІЛа¶ЬаІЗථаІЗа¶∞ ඙аІНа¶∞а¶Ња¶ѓа¶Љ а¶Ха¶Ња¶Ыа¶Ња¶Ха¶Ња¶Ыа¶њ (аІѓаІ®%) а¶Еඕа¶Ъ а¶Па¶Яа¶њ а¶ЕබඌයаІНа¶ѓ а¶У а¶Е඙аІЗа¶ХаІНа¶Ја¶Ња¶ХаІГට а¶Ха¶Ѓ а¶ђаІНඃඌ඙ථаІАа¶ѓа¶Љ (less diffusible)а•§ а¶Па¶ЬථаІНа¶ѓ а¶П а¶Ха¶Ња¶ЬаІЗ а¶єа¶Ња¶За¶°аІНа¶∞аІЛа¶ЬаІЗථ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶Еа¶Іа¶ња¶Х а¶Й඙ඃаІЛа¶ЧаІАа•§[аІѓ]
(аІ®) а¶∞а¶ХаІНටаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶Еа¶Іа¶ња¶Хටа¶∞ බаІНа¶∞а¶ђа¶£аІАа¶ѓа¶Ља•§ а¶Па¶З а¶ЬථаІНа¶ѓ а¶°аІБа¶ђаІБа¶∞аІА ඃථаІНටаІНа¶∞аІЗ а¶ђа¶Ња¶ѓа¶ЉаІБа¶∞ ඙а¶∞а¶ња¶ђа¶∞аІНටаІЗ а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථаІЗа¶∞ ඪඌඕаІЗ ඁගපаІНа¶∞ගට а¶Еа¶ђа¶ЄаІНඕඌඃඊ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ (аІ®аІ¶% а¶ЩаІ® а¶У аІЃаІ¶% а¶Ра¶ђ) а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§ а¶ПටаІЗ а¶Єа¶ЃаІБබаІНа¶∞аІЗа¶∞ ටа¶≤බаІЗපаІЗ а¶Йа¶ЪаІНа¶Ъ а¶Ъඌ඙аІЗ а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ පаІНа¶ђа¶Ња¶Є-඙аІНа¶∞පаІНа¶ђа¶Ња¶ЄаІЗа¶∞ а¶ѓаІЗ а¶Еа¶ЄаІБа¶ђа¶ња¶Іа¶Њ а¶єа¶ѓа¶Љ ටඌ බаІВа¶∞аІАа¶≠аІВට а¶єа¶ѓа¶Ља•§ а¶Ха¶Ња¶∞а¶£ а¶Йа¶ЪаІНа¶Ъ а¶Ъඌ඙аІЗ а¶ђа¶Ња¶ѓа¶ЉаІБටаІЗ ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶∞а¶ХаІНටаІЗ බаІНа¶∞а¶ђаІАа¶≠аІВට а¶єа¶ѓа¶ЉаІЗ а¶ѓа¶Ња¶ѓа¶Љ а¶Жа¶∞ ඙ඌථගа¶∞ а¶Й඙а¶∞аІЗ а¶Йආඌ ඁඌටаІНа¶∞а¶З а¶Ъඌ඙ а¶Ха¶ЃаІЗ а¶ѓа¶Ња¶ѓа¶Љ, а¶Ђа¶≤аІЗ බаІНа¶∞а¶ђаІАа¶≠аІВට ථඌа¶За¶ЯаІНа¶∞аІЛа¶ЬаІЗථ а¶ђаІЗа¶∞ а¶єа¶ѓа¶ЉаІЗ а¶Жа¶ЄаІЗ а¶Па¶ђа¶В а¶∞а¶ХаІНටаІЗа¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗ а¶ђаІБබබ а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶Ха¶∞аІЗа•§ а¶ПටаІЗ а¶Еа¶Ха¶ЄаІНа¶Ѓа¶ЊаІО а¶ђаІНඃඕඌ а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶єа¶ѓа¶Ља•§ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ѓаІБа¶ХаІНට а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞аІЗ а¶Па¶З а¶Еа¶ЄаІБа¶ђа¶ња¶Іа¶Њ а¶єа¶ѓа¶Љ а¶®а¶Ња•§[аІІаІ¶]
(аІ©) а¶єа¶Ња¶Б඙ඌථаІА ඙аІНа¶∞а¶≠аІГටග а¶∞аІЛа¶ЧаІЗ පаІНа¶ђа¶Ња¶Єа¶Ха¶Ња¶∞аІНа¶ѓаІЗа¶∞ ඪයඌඃඊටඌа¶∞ а¶ЬථаІНа¶ѓ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඁගපаІНа¶∞ගට а¶Еа¶ХаІНа¶Єа¶ња¶ЬаІЗථ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ™) ථගඁаІНථ ටඌ඙ඁඌටаІНа¶∞а¶Ња¶∞ а¶Ча¶ђаІЗа¶Ја¶£а¶Ња¶Ха¶Ња¶∞аІНа¶ѓаІЗ ටа¶∞а¶≤ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ (аІ™.аІІ K) а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІЂ) ථගඁаІНථ ටඌ඙ඁඌටаІНа¶∞а¶Њ ඙а¶∞ගඁඌ඙аІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶ЧаІНа¶ѓа¶Ња¶Є ඕඌа¶∞аІНа¶ЃаІЛа¶Ѓа¶ња¶Яа¶Ња¶∞аІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІђ) а¶Єа¶єа¶ЬаІЗа¶З а¶Ьа¶Ња¶∞ගට а¶єа¶ѓа¶Љ а¶Пඁථ ඲ඌටаІБ а¶У ඲ඌටаІБ а¶Єа¶Ва¶Ха¶∞аІЗа¶∞ а¶Ча¶≤ථ а¶Па¶ђа¶В а¶ЬаІЛа¶°а¶Ља¶Њ а¶≤а¶Ња¶ЧඌථаІЛа¶∞ а¶Єа¶Ѓа¶ѓа¶Љ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ ඙а¶∞а¶ња¶ђаІЗප а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶Ха¶∞ටаІЗ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ≠) а¶ђа¶Ња¶ѓа¶ЉаІБ а¶Е඙аІЗа¶ХаІНа¶Ја¶Њ а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶єа¶Ња¶≤а¶Ха¶Њ а¶ђа¶≤аІЗ а¶Па¶Яа¶њ а¶ђаІГයබඌа¶Ха¶Ња¶∞ а¶Жа¶Хඌප ඃඌථаІЗа¶∞ а¶Яа¶Ња¶ѓа¶Ља¶Ња¶∞аІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§[аІІаІІ]
(аІЃ) а¶Па¶∞ ඪඌථаІНබаІНа¶∞ටඌ (viscosity ) а¶Па¶Ха¶ЯаІБ а¶Еа¶Іа¶ња¶Х а¶ђа¶≤аІЗ а¶Ха¶ЃаІН඙ඌඪ а¶У ථඌඐගа¶ХබаІЗа¶∞ а¶ЕථаІНඃඌථаІНа¶ѓ ඃථаІНටаІНа¶∞аІЗ а¶Па¶Яа¶њ а¶°аІНа¶ѓа¶Ња¶ЃаІН඙ඌа¶∞ (damper) а¶єа¶ња¶ЄаІЗа¶ђаІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІѓ) а¶Па¶Яа¶њ а¶ђаІИබаІНа¶ѓаІБටගа¶Х а¶ЯаІНа¶∞ඌථаІНа¶Єа¶Ђа¶∞а¶Ѓа¶Ња¶∞, а¶Яа¶ња¶Йа¶ђ а¶≤а¶Ња¶За¶Я а¶У а¶∞аІЗа¶°а¶ња¶У а¶Яа¶ња¶Йа¶ђаІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІІаІ¶) а¶Ѓа¶Ња¶Яа¶ња¶∞ ථගа¶ЪаІЗ ඙аІЗа¶ЯаІНа¶∞аІЛа¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ а¶ЄаІНඕඌථඌථаІНටа¶∞ ථගа¶∞аІНබаІЗපථඌඃඊ а¶ЯаІНа¶∞аІЗа¶Єа¶Ња¶∞ (tracer) а¶ЧаІНа¶ѓа¶Ња¶Є а¶єа¶ња¶ЄаІЗа¶ђаІЗ а¶Па¶Яа¶њ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
ථගඃඊථ
(аІІ) ථගඃඊථ ඙аІНа¶∞඲ඌථට а¶Жа¶≤аІЛа¶Х а¶ЙаІО඙ඌබථ а¶У а¶Жа¶≤аІЛа¶Ха¶Єа¶ЬаІНа¶Ьа¶Ња¶ѓа¶Љ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§ ථගඃඊථ-а¶Яа¶ња¶Йа¶ђаІЗ а¶Па¶Яа¶њ а¶ЕටаІНа¶ѓаІБа¶ЬаІНа¶ЬаІНа¶ђа¶≤ а¶≤а¶Ња¶≤ а¶Жа¶≤аІЛ а¶ЙаІО඙ඌබථ а¶Ха¶∞аІЗа•§ а¶Па¶Яа¶њ ඙ඌа¶∞බ (а¶Ѓа¶Ња¶∞а¶Ха¶Ња¶∞а¶њ) а¶ђа¶Ња¶ЈаІН඙аІЗа¶∞ ඪඌඕаІЗ ඁගපаІНа¶∞ගට ඕඌа¶Ха¶≤аІЗ а¶Єа¶ђаІБа¶Ь а¶ђа¶Њ ථаІАа¶≤ а¶Жа¶≤аІЛ ඙ඌа¶Уа¶ѓа¶Ља¶Њ а¶ѓа¶Ња¶ѓа¶Ља•§ ථගඃඊථ а¶ЧаІНа¶ѓа¶Ња¶Є а¶ђа¶Њ ටඌа¶∞ а¶ђа¶ња¶≠ගථаІНථ ඁගපаІНа¶∞а¶£аІЗа¶∞ ඪඌඕаІЗ а¶ђа¶ња¶≠ගථаІНථ а¶ђа¶∞аІНа¶£аІЗа¶∞ а¶Ха¶Ња¶Ъ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶Ха¶∞аІЗ а¶Жа¶≤аІЛа¶∞ а¶ђаІИа¶Ъගට а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶Ха¶∞а¶Њ а¶Єа¶ЃаІНа¶≠а¶ђа•§ ථගඃඊථ а¶Жа¶≤аІЛ а¶ХаІБа¶ѓа¶Ља¶Ња¶Єа¶Ња¶∞ а¶Ѓа¶ІаІНа¶ѓаІЗа¶У බаІЗа¶Ца¶Њ а¶ѓа¶Ња¶ѓа¶Љ -а¶Па¶З а¶ЬථаІНа¶ѓ а¶ђаІИඁඌථගа¶Ха¶Ча¶£ а¶Жа¶≤аІЛа¶Х-а¶Єа¶Ва¶ХаІЗටа¶∞аІВ඙аІЗ а¶Па¶З а¶Жа¶≤аІЛ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶Ха¶∞аІЗ ඕඌа¶ХаІЗа¶®а•§
(аІ®) ථගඃඊථаІЗа¶∞ а¶Єа¶Ња¶єа¶Ња¶ѓаІНа¶ѓаІЗ ඙аІНа¶∞ටග඙аІНа¶∞а¶≠ ථа¶≤аІЗ а¶Жа¶≤аІЛа¶∞ а¶ђаІИа¶ЪගටаІНа¶∞аІНа¶ѓ а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶Ха¶∞аІЗ а¶ђаІНа¶ѓа¶ђа¶Єа¶Ња¶ѓа¶Љ а¶ХаІНа¶ЈаІЗටаІНа¶∞аІЗ а¶∞а¶Ха¶Ѓа¶Ња¶∞а¶њ а¶ђа¶ња¶ЬаІНа¶Юඌ඙ථаІЗ ථගඃඊථ ඃඕаІЗа¶ЈаІНа¶Я ඙а¶∞а¶ња¶Ѓа¶Ња¶£аІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ©) а¶ХаІЛථ ථගබගඣаІНа¶Я а¶ђа¶ња¶≠а¶ђ а¶ЄаІАа¶Ѓа¶Њ (voltage limit) а¶Еටගа¶ХаІНа¶∞ඌථаІНට ථඌ а¶єа¶Уа¶ѓа¶Ља¶Њ ඙а¶∞аІНඃථаІНට ථගඃඊථ-а¶єа¶ња¶≤а¶ња¶ѓа¶Ља¶Ња¶Ѓ ඁගපаІНа¶∞а¶£ ඐගබаІНа¶ѓаІБаІО ඙а¶∞ගඐයථ а¶Ха¶∞аІЗ а¶®а¶Ња•§ а¶Па¶З ඁඌටаІНа¶∞а¶Њ а¶Еа¶∞аІНඕඌаІО а¶Йа¶ЪаІНа¶Ъ а¶ђа¶ња¶≠а¶ђ ඙аІНа¶∞а¶ѓа¶ЉаІЛа¶Ч а¶єа¶≤аІЗ а¶Па¶Яа¶њ ඐගබаІНа¶ѓаІБаІО ඙а¶∞а¶ња¶ђа¶Ња¶єаІАа•§ а¶Ха¶Ња¶ЬаІЗа¶З а¶≠аІЛа¶≤аІНа¶Яа¶Ѓа¶ња¶Яа¶Ња¶∞ а¶У а¶∞аІЗа¶Ха¶Яа¶ња¶Ђа¶Ња¶ѓа¶Ља¶Ња¶∞ ඙аІНа¶∞а¶≠аІГටග ඃථаІНටаІНа¶∞аІЗа¶∞ а¶Єа¶Ва¶∞а¶ХаІНа¶Ја¶£аІЗ а¶Па¶З ඁගපаІНа¶∞а¶£ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
а¶Жа¶∞аІНа¶Чථ
(аІІ) а¶Жа¶∞аІНа¶Чථ ඙аІНа¶∞඲ඌථට а¶За¶≤аІЗа¶Ха¶ЯаІНа¶∞а¶ња¶Х а¶ђа¶Ња¶≤аІНа¶ђ ඙аІВа¶∞а¶£аІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§ а¶ђа¶Ња¶≤аІНа¶ђаІЗ а¶Жа¶∞аІНа¶Чථ ඕඌа¶Ха¶Ња¶∞ බа¶∞аІБථ а¶Яа¶Ња¶Ва¶ЄаІНа¶ЯаІЗථ а¶ЄаІВටаІНа¶∞ (tungsten filament) а¶Єа¶єа¶ЬаІЗ а¶ђа¶Ња¶ЈаІН඙аІАа¶≠аІВට а¶єа¶ѓа¶Љ ථඌ а¶Ђа¶≤аІЗ а¶ђа¶Ња¶≤а¶ђаІЗа¶∞ ඙а¶∞а¶Ѓа¶Ња¶ѓа¶ЉаІБ а¶ЕථаІЗа¶Ха¶Ња¶ВපаІЗ а¶ђа¶∞аІН඲ගට а¶єа¶ѓа¶Ља•§
(аІ®) а¶∞аІЗа¶°а¶ња¶У-а¶Па¶∞ а¶ђа¶Ња¶≤аІНа¶ђ а¶У а¶∞аІЗа¶Ха¶Яа¶ња¶Ђа¶Ња¶ѓа¶Ља¶Ња¶∞-а¶П а¶Жа¶∞аІНа¶Чථ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ©) а¶Эа¶Ња¶≤а¶Ња¶З-а¶Па¶∞ а¶Ха¶Ња¶ЬаІЗ ථගඣаІНа¶ХаІНа¶∞а¶ња¶ѓа¶Љ ඙а¶∞а¶ња¶ђаІЗප а¶ЄаІГа¶ЈаІНа¶Яа¶њ а¶Ха¶∞ටаІЗ а¶Жа¶∞аІНа¶Чථ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ™) а¶ЧаІНа¶ѓа¶Ња¶Є а¶ХаІНа¶≤аІЛа¶Ѓа¶Ња¶ЯаІЛа¶ЧаІНа¶∞а¶Ња¶ЂаІАටаІЗа¶У а¶Па¶∞ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶Жа¶ЫаІЗа•§
а¶ХаІНа¶∞ග඙аІНа¶Яථ
(аІІ) а¶Жа¶∞аІНа¶ЧථаІЗа¶∞ ඁට а¶ХаІНа¶∞ග඙а¶Яථа¶У а¶Яа¶ња¶Йа¶ђ ඐඌටගටаІЗ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ®) а¶Ха¶Єа¶Ѓа¶ња¶Х а¶∞පаІНа¶Ѓа¶њ ඙а¶∞ගඁඌ඙аІЗ а¶ЖඃඊථаІАа¶Ха¶∞а¶£ ඙аІНа¶∞а¶ХаІЛа¶ЈаІНආаІЗ (Ionisation chamber) а¶ХаІНа¶∞ග඙а¶Яථ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ©) а¶ХаІНа¶∞ග඙а¶Яථ ඙ඌа¶∞а¶Ѓа¶Ња¶£а¶ђа¶ња¶Х බаІА඙ (Krypton atomic lamp) ථගа¶∞аІНа¶Ѓа¶Ња¶£аІЗ Kr 85-а¶Па¶∞ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶Жа¶ЫаІЗа•§
(аІ™) а¶Цථග-පаІНа¶∞а¶Ѓа¶ња¶ХබаІЗа¶∞ вАШа¶ХаІНඃඌ඙-а¶≤аІНа¶ѓа¶Ња¶ЃаІН඙аІЗвАЩ а¶ХаІНа¶∞ග඙а¶Яථ а¶ђаІНа¶ѓа¶ђа¶єа¶Ња¶∞ а¶Ха¶∞а¶Њ а¶єа¶ѓа¶Ља•§
а¶ЬаІЗථථ
(аІІ) බаІНа¶∞аІБට а¶ЧටගඪඁаІН඙ථаІНථ а¶ЂаІНа¶≤ඌප-а¶≤а¶Ња¶За¶ЯаІЗ а¶ЬаІЗථථ а¶Жа¶ЫаІЗа•§
(аІ®) ථගа¶Йа¶ЯаІНа¶∞ථ Y-а¶∞පаІНа¶Ѓа¶њ а¶У ථගа¶∞඙аІЗа¶ХаІНа¶Ј а¶ЃаІЗඪථ (meson) а¶Ха¶£а¶Њ පථඌа¶ХаІНටа¶Ха¶∞а¶£аІЗ а¶ђаІБබඐаІБබ ඙аІНа¶∞а¶ХаІЛа¶ЈаІНආ (Bubble chamber) ටаІИа¶∞а¶њ а¶Ха¶∞ටаІЗ а¶Па¶Яа¶њ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
а¶∞аІЗධථ
(аІІ) а¶∞аІЗа¶°а¶ња¶У-ඕаІНа¶ѓа¶Ња¶∞ඌ඙ග а¶Ъа¶ња¶Ха¶њаІОа¶Єа¶Ња¶ѓа¶Љ පа¶∞аІАа¶∞аІЗ а¶ХаІНඣටගа¶Ха¶∞ а¶ђаІГබаІНа¶Іа¶њ ථඌපаІЗ а¶Па¶Яа¶њ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
(аІ®) а¶ХаІНඃඌථඪඌа¶∞аІЗа¶∞ ඁට බаІБа¶∞а¶Ња¶∞аІЛа¶ЧаІНа¶ѓ а¶ђаІНа¶ѓа¶Ња¶Іа¶њ ථගа¶∞ඪථаІЗа¶У а¶∞аІЗධථ а¶ђаІНа¶ѓа¶ђа¶єаІГට а¶єа¶ѓа¶Ља•§
а¶ђа¶∞аІНа¶£ а¶ђа¶ња¶ЪаІНа¶ЫаІБа¶∞а¶£
ටඕаІНа¶ѓа¶ЄаІВටаІНа¶∞
- вЖС а¶Жа¶За¶За¶Й඙аІНа¶ѓа¶Ња¶Х а¶ЕථаІБа¶Єа¶Ња¶∞аІЗ а¶Ѓа¶Ња¶ЭаІЗ а¶Ѓа¶Ња¶ЭаІЗ පаІВථаІНඃටඁ පаІНа¶∞аІЗа¶£аІАа¶У а¶ђа¶≤а¶Њ а¶єа¶ѓа¶Љ)
- вЖС а¶®аІЛа¶ђа¶≤ а¶ЧаІНа¶ѓа¶Ња¶Єа¶Єа¶ЃаІВа¶є
- вЖС а¶∞ඪඌඃඊථаІЗа¶∞ а¶Зටගයඌඪ - ථаІЛа¶ђа¶≤ а¶ЧаІНа¶ѓа¶Ња¶Єа¶Єа¶ЃаІВа¶є
- вЖС Lodders, Katharina (аІ®аІ¶аІ¶аІ©)а•§ "Solar System Abundances and Condensation Temperatures of the Elements"а•§ The Astrophysical Journalа•§ 591 (2): 1220вАУ1247а•§ а¶°а¶ња¶Уа¶Жа¶З:10.1086/375492а•§ а¶ђа¶ња¶ђа¶ХаІЛа¶°:2003ApJ...591.1220Lа•§
- вЖС "The Atmosphere"а•§ National Weather Serviceа•§ а¶Єа¶Ва¶ЧаІНа¶∞а¶єаІЗа¶∞ ටඌа¶∞а¶ња¶Ц аІ®аІ¶аІ¶аІЃ-аІ¶аІђ-аІ¶аІІа•§
- вЖС H√§ussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-J√ґrg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann (аІ®аІ¶аІ¶аІ®)а•§ "Noble gases"а•§ Ullmann's Encyclopedia of Industrial Chemistryа•§ Wileyа•§ а¶°а¶ња¶Уа¶Жа¶З:10.1002/14356007.a17_485а•§
- вЖС Greenwood 1997, ඙аІГ. 891
- вЖС а¶ЧаІНа¶∞аІБ඙ аІІаІЃ ථаІЛа¶ђа¶≤ а¶ЧаІНа¶ѓа¶Ња¶Єа¶Єа¶ЃаІВа¶є
- вЖС Freudenrich, Craig (аІ®аІ¶аІ¶аІЃ)а•§ "How Blimps Work"а•§ HowStuffWorksа•§ а¶Єа¶Ва¶ЧаІНа¶∞а¶єаІЗа¶∞ ටඌа¶∞а¶ња¶Ц аІ© а¶ЬаІБа¶≤а¶Ња¶З аІ®аІ¶аІ¶аІЃа•§
- вЖС Fowler, B.; Ackles, K. N.; Porlier, G. (аІІаІѓаІЃаІЂ)а•§ "Effects of inert gas narcosis on behaviorвАФa critical review"а•§ Undersea Biomed. Res.а•§ 12 (4): 369вАУ402а•§ а¶Жа¶За¶Па¶Єа¶Па¶Єа¶Пථ 0093-5387а•§ а¶Уа¶Єа¶ња¶Па¶≤а¶Єа¶њ 2068005а•§ ඙ගа¶Па¶Ѓа¶Жа¶За¶°а¶њ 4082343а•§ Archived from the original on аІ®аІЂ а¶°а¶ња¶ЄаІЗа¶ЃаІНа¶ђа¶∞ аІ®аІ¶аІІаІ¶а•§ а¶Єа¶Ва¶ЧаІНа¶∞а¶єаІЗа¶∞ ටඌа¶∞а¶ња¶Ц аІЃ а¶П඙аІНа¶∞а¶ња¶≤ аІ®аІ¶аІ¶аІЃа•§
- вЖС Freudenrich, Craig (аІ®аІ¶аІ¶аІЃ)а•§ "How Blimps Work"а•§ HowStuffWorksа•§ а¶Єа¶Ва¶ЧаІНа¶∞а¶єаІЗа¶∞ ටඌа¶∞а¶ња¶Ц аІ© а¶ЬаІБа¶≤а¶Ња¶З аІ®аІ¶аІ¶аІЃа•§